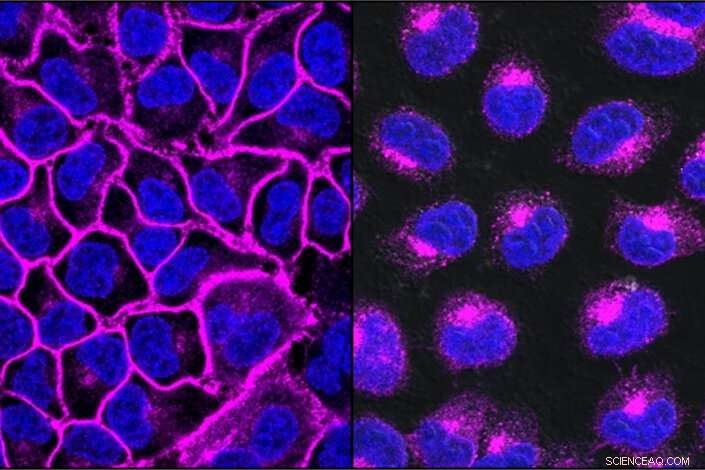
EGFR, una proteína importante para ayudar a que los cánceres crezcan, se muestra aquí en violeta, decora la superficie de la celda (izquierda). Después del tratamiento con un LYTAC dirigido a EGFR, toda la proteína EGFR se transporta a los lisosomas, los compartimentos de degradación dentro de la celda (derecha). Crédito:Steven Banik
Cuando los científicos encuentran una proteína potencialmente peligrosa en una célula, podrían imaginarse encogiéndose para convertirse en pequeños cirujanos, eliminando solo la molécula problemática y dejando intactas las partes sanas de la célula. Si bien las manos hábiles y los instrumentos afilados nunca podrían extraer una sola proteína de la superficie de una célula, una nueva herramienta molecular podría facilitar la cirugía celular, según un estudio publicado en Naturaleza el 29 de julio.
Los químicos de Stanford han desarrollado una nueva clase de moléculas que transportan proteínas no deseadas desde la superficie o el entorno circundante de una célula al lisosoma. el compartimento celular dedicado a la degradación de proteínas. Estas moléculas, llamadas quimeras dirigidas a lisosomas, o LYTACs, funcionan marcando selectivamente una proteína con una etiqueta que selle su destino para la eliminación de basura celular. Esta degradación selectiva podría ayudar a los investigadores a estudiar y tratar enfermedades como el cáncer y el Alzheimer. cuyas causas están ligadas a proteínas de superficie.
"Es como un bisturí molecular, "dijo el autor principal Steven Banik, un postdoctorado en el laboratorio de Carolyn Bertozzi, la profesora Anne T. y Robert M. Bass en la Facultad de Humanidades y Ciencias. "Esta herramienta le permite acelerar la degradación natural de una proteína individual entre todas las diferentes proteínas que se encuentran dentro o fuera de una célula".
Las proteínas son vitales para muchos procesos biológicos como el metabolismo y la comunicación intercelular, pero algunos también pueden ayudar a que enfermedades como el cáncer se propaguen y eviten la regulación inmunológica. Los métodos tradicionales para obstaculizar a estos malos actores implican el uso de medicamentos que bloquean el sitio activo de la proteína, donde otros componentes celulares pueden acoplarse mientras la proteína trabaja en ellos, generalmente moviendo los átomos. Pero esta estrategia de bloqueo es imperfecta; a veces, el bolsillo de unión es demasiado poco profundo y el inhibidor se dispara demasiado rápido. Otros tiempos, la actividad de una proteína se deriva de sus propiedades físicas, como su rigidez, y no de ningún sitio activo, por lo que bloquear una pequeña porción de la proteína completa es insuficiente. En estos casos, drenar la célula de la proteína es la única opción.
La degradación de proteínas como estrategia terapéutica ha sido especialmente popular desde el desarrollo de PROTAC, o proteólisis dirigida a quimeras, hace 20 años. PROTACs, que buscan y etiquetan proteínas intracelulares para su degradación, han tenido éxito en los laboratorios de investigación y en los primeros estudios clínicos, pero dependen de una vía de degradación que es inaccesible para aproximadamente el 40 por ciento de todas las proteínas que se encuentran encima o fuera de la membrana celular. Bertozzi y Banik no aceptaron que ciertas proteínas y enfermedades estuvieran fuera de su alcance.
"Mi laboratorio siempre ha estado interesado en lo que sucede en la superficie celular, que contiene todas estas proteínas importantes para la modulación inmunológica, "dijo Bertozzi, quien también es el codirector de la familia Baker de Stanford ChEM-H. "Hemos identificado muchas proteínas de superficie y secretadas que creemos que desempeñan funciones patógenas en el cáncer, y los LYTAC podrían ayudarnos a comprenderlos mejor y explorarlos como objetivos farmacológicos ".
La clave para que la herramienta funcione es su diseño bifuncional. Un lado de esta molécula puede personalizarse para unirse a cualquier proteína de interés. En el otro lado hay una secuencia corta de aminoácidos, o péptido, salpicado de un azúcar llamado manosa-6-fosfato.
Este azúcar sirve como etiqueta de contabilidad para la célula. Cuando la célula construye proteínas que pertenecen al lisosoma, agrega estos azúcares para asegurar que lleguen a su destino. "Manosa-6-fosfato actúa como un código postal, "dijo Banik." Estos azúcares le dicen a la célula, Llevo esta proteína al lisosoma. Por favor, envíame allí '". Hay receptores en la superficie celular que interactúan con esta capa de azúcar, y cuando agarran una molécula de LYTAC y la introducen en la célula, las proteínas marcadas son arrastradas con él.
Al unir esta etiqueta a las proteínas, Los LYTAC secuestran un mecanismo de transporte celular natural diseñado para acompañar a las proteínas lisosomales recién sintetizadas a su nuevo hogar. Pero mientras que las proteínas lisosomales son lo suficientemente resistentes para sobrevivir a las enzimas degradantes que encuentran en el lisosoma, la mayoría de las proteínas no lo son, por lo que los etiquetados con el método LYTAC generalmente se destruyen.
Los investigadores de Stanford muestran que, en celdas, pueden atacar y degradar proteínas importantes en la enfermedad de Alzheimer y el cáncer. Según ellos, el extremo de unión a proteínas del LYTAC puede ser cualquier cosa que se una a una proteína, como un anticuerpo o un fármaco existente, así que en el futuro muchas otras proteínas y enfermedades podrían ser atacadas.
"Con estrategias de degradación de proteínas, no solo puede expandir lo que se puede drogar, sino también mejorar las terapias que ya existen, "dijo Bertozzi." Cada célula tiene lisosomas. Cada célula ya tiene una forma de degradar las proteínas. No importa cuál sea tu objetivo, si puedes conseguir un LYTAC allí, puedes degradarlo ".