Crédito:Universidad de California, los Angeles
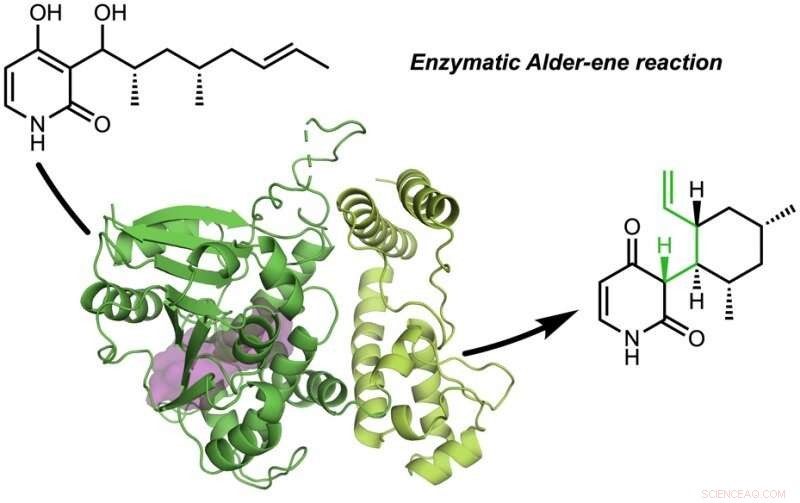
El Tang, Garg, y los grupos de investigación de Houk han descubierto los catalizadores de proteínas naturales de la naturaleza (enzimas) que catalizan la reacción de Alder-eno.
Todos los grupos son parte del Departamento de Química y Bioquímica de UCLA. El profesor Yi Tang es el profesor rector del Departamento de Ingeniería Química y Biomolecular de UCLA y también ocupa un cargo conjunto en el Departamento de Bioingeniería. El profesor Ken Houk ocupa la Cátedra Distinguida de Investigación Saul Winstein en Química Orgánica y el profesor Neil Garg ocupa la Cátedra Kenneth N. Trueblood en Química y Bioquímica y se desempeña como Director del Departamento.
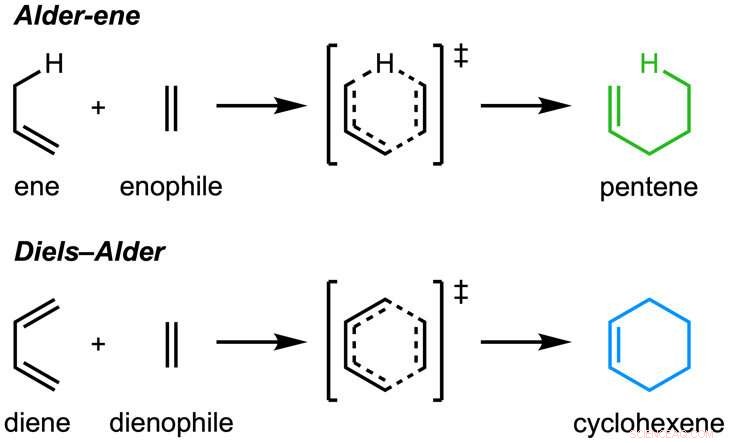
El papel, "Una reacción enzimática de Alder-eno" se publicó en Naturaleza . La reacción de Alder-ene se descubrió en 1943, pero hasta ahora se ha utilizado únicamente para síntesis química en el laboratorio. La reacción de Alder-eno es un ejemplo de reacción pericíclica y un análogo de la reacción de Diels-Alder ampliamente conocida. Previamente, Tang y Houk identificaron una nueva clase de enzimas, las periciclasas, por su capacidad para acelerar las reacciones pericíclicas en el metabolismo primario y secundario.
En colaboración con Jiahai Zhou del Instituto de Química Orgánica de Shanghai, los grupos Tang-Garg-Houk informaron las estructuras y mecanismos de dos grupos de enzimas que catalizan una deshidratación estereoselectiva y una reacción pericíclica concomitante, mostrado a continuación, donde los pequeños símbolos como PdxI indican enzimas naturales (catalizadores de proteínas) descubiertas por el grupo Tang. Un grupo de enzimas cataliza una reacción de Alder-eno, y el segundo catalizar reacciones hetero-Diels-Alder.
Crédito:Universidad de California, los Angeles

Crédito:Universidad de California, los Angeles
El artículo describe la síntesis divergente de piridoxatina y asperpiridona A. Partiendo del sustrato de alcohol, las enzimas facilitan la deshidratación para formar un intermedio de metido de quinona reactivo a partir del cual los esqueletos de piridoxatina y asperpiridona A pueden formarse mediante la reacción de Alder-eno o Diels-Alder. Masao Ohashi en el grupo Tang, y Cooper Jamieson en los grupos de Houk y Tang trabajaron juntos para identificar los factores en las enzimas que controlan qué reacción ocurre. Las predicciones computacionales guiaron modificaciones experimentales que alteraron las enzimas para catalizar la otra reacción. Este tipo de ingeniería de proteínas promete influir en la síntesis de laboratorio de productos naturales relacionados en el futuro.
Crédito:Universidad de California, los Angeles
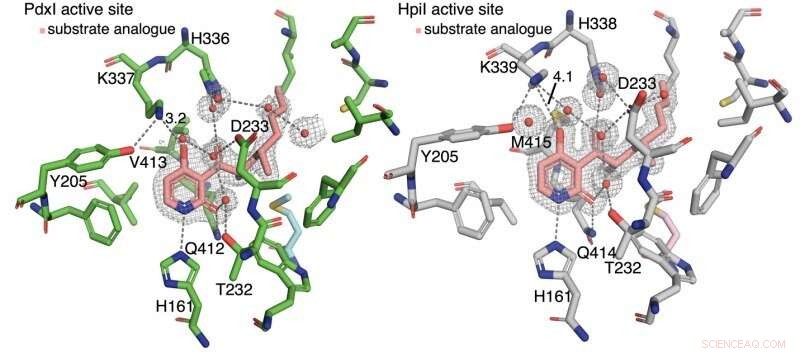
Los autores descubrieron que el enlace de hidrógeno con la piridona C4 controla el tipo de reacción. En enzimas PdxI, AdxI, y MdxI, un hidrógeno del residuo de lisina (K337) se une a C4. Esto disminuye la nucleofilia del oxígeno y desfavorece la reacción hetero-Diels-Alder. PdxI, AdxI, y MdxI utilizan esta estrategia para formar selectivamente el esqueleto de piridoxatina. Enzimas EpiI, UpiI, y HpiI bloquean la aparición de este enlace de hidrógeno con un residuo de metionina flexible (M415) y, por tanto, facilitan la formación del esqueleto de asperpiridona A. Esta sutil diferencia geométrica en los sitios activos produce un cambio electrónico bastante grande en el sustrato y controla la reacción enzimática pericíclica.