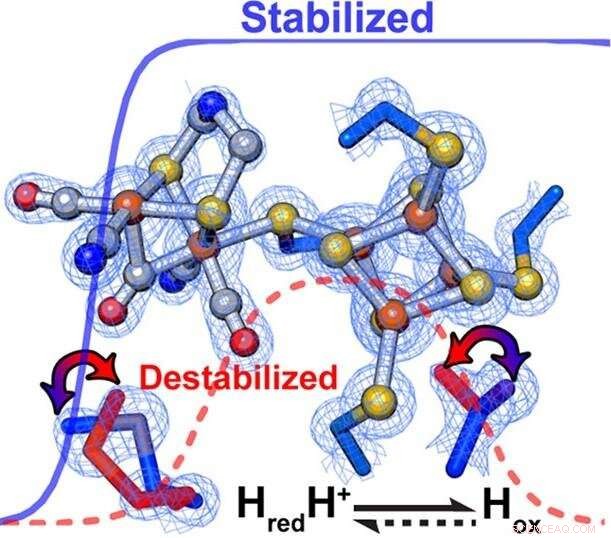
Los investigadores encontraron que los cambios sutiles en el andamio de proteínas que rodea el centro catalítico de una enzima controlan de manera exquisita la velocidad y la dirección de las reacciones químicas. Dentro de [FeFe] -hidrogenasas, las interacciones secundarias influyeron directamente en la estabilización / desestabilización relativa de los diferentes estados de oxidación del grupo de metales del sitio activo. Crédito:PNNL
A medida que los investigadores buscan formas de desarrollar y mejorar productos cotidianos que van desde combustibles hasta medicamentos, las enzimas proporcionan el ejemplo natural del control necesario para que las reacciones químicas funcionen de la forma deseada. Pero un fenómeno conocido como sesgo catalítico sigue desconcertando a los científicos.
El andamio de proteína alrededor del núcleo catalítico de una enzima controla exquisitamente la reactividad, incluyendo la dirección y velocidad de los procesos químicos. Los científicos se refieren a este ajuste fino como "sesgo catalítico", y cómo ocurre sigue siendo un tema de debate generalizado.
El misterio está un paso más cerca de resolverse.
Un equipo de investigación de tres laboratorios nacionales del Departamento de Energía de EE. UU. (DOE) y cuatro universidades descubrió que los cambios sutiles en el entorno que rodea a algunas enzimas no solo pueden cambiar la velocidad de una reacción celular en seis órdenes de magnitud asombrosos, sino también su dirección. Esa inversión, la raíz del dilema del sesgo catalítico, es como acelerar en una dirección a 10 millas por segundo, luego yendo en la dirección opuesta en 1, 000, 000 millas por segundo. La brecha se acumula rápidamente.
"Dependiendo del resultado deseado, el sesgo podría ser insuperable o una de las mejores cosas que jamás haya sucedido, "dijo Simone Raugei, un científico computacional en PNNL y coautor del estudio. "Una reacción puede tener muchos intermedios y puede tomar múltiples vías, algunas más eficientes que otras. Por lo tanto, poder ajustar el entorno del catalizador puede marcar una diferencia notable en la velocidad de reacción".
Los resultados, reportado en el Revista de la Sociedad Química Estadounidense , tienen implicaciones significativas para el diseño de catalizadores sintéticos utilizados en entornos industriales, donde es fundamental predecir y controlar el comportamiento de una reacción. Los resultados también proporcionan una mayor comprensión fundamental de los factores que controlan los procesos metabólicos en toda la vida.
Sesgo catalítico en metaloenzimas
En naturaleza, el microbio Clostridium pasteurianum (Cp) produce varias enzimas a base de hierro, [FeFe] -hidrogenasas, que se encuentran entre un gran grupo de metaloenzimas. Las metaloenzimas están involucradas en una multitud de reacciones que cumplen muchas funciones, como mover hidrógeno a través de comunidades microbianas, agarrando nitrógeno del aire, produciendo metano, y conversión de carbohidratos.
La versatilidad hace que las metaloenzimas, y [FeFe] -hidrogenasas específicamente, temas ideales para explorar cuestiones fundamentales relacionadas con las transformaciones químicas. De hecho, Las hidrogenasas han sido la fuente de inspiración para numerosos estudios de electrocatálisis en reacciones de conversión de energía financiados a través de la Oficina de Ciencias Energéticas Básicas del DOE. dijo Morris Bullock, director del Centro de Electrocatálisis Molecular, un Centro de Investigación de la Frontera Energética del DOE.
"Los descubrimientos informados por diferentes grupos de investigación que utilizan enfoques complementarios enriquecen nuestra comprensión de la base científica fundamental de la catálisis por sistemas biológicos y moleculares, "dijo Bullock.
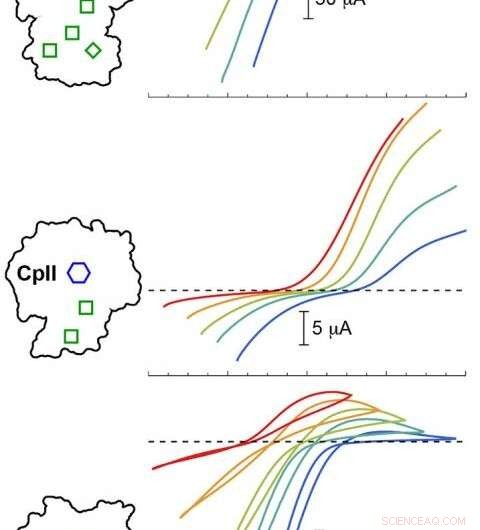
El modelado computacional PNNL validó experimentos con tres hidrogenasas Cp a diferentes valores de pH. Los resultados mostraron que el potencial catalítico (curvas de colores) variaba dependiendo de la disposición del H-Cluster (hexágono azul) y los grupos accesorios (cajas verdes). Las trazas de colores debajo de la línea discontinua corresponden a la producción de hidrógeno, mientras que los trazos por encima de la línea discontinua corresponden a la oxidación del hidrógeno. Crédito: Mermelada. Chem. Soc . 2020, 142, 3, 1227-1235
John Peters, designado conjuntamente por la PNNL, es profesor en la Universidad Estatal de Washington (WSU) y director de Catálisis y Transferencia de Electrones y Biológicos, otro Centro de Investigación de la Frontera Energética del DOE. Peters comenzó a estudiar las [FeFe] -hidrogenasas a fines de la década de 1990 utilizando enzimas que se encuentran en el microbio Cp. Pero esos estudios anteriores se centraron en aspectos mecanicistas generales, y solo recientemente los investigadores han comenzado a pensar en las enzimas en el contexto del sesgo catalítico.
Peters y Paul King, gerente del Grupo de Bioquímica Física y Fotosíntesis del Laboratorio Nacional de Energías Renovables (NREL), co-diseñó el nuevo estudio con Raugei en PNNL y Anne Jones, profesor asociado de la Facultad de Ciencias Moleculares de la Universidad Estatal de Arizona (ASU).
El estudio tuvo como objetivo identificar cómo tres [FeFe] -hidrogenasas difieren en el control de la reducción de protones a hidrógeno molecular, así como la reacción inversa:oxidación de hidrógeno molecular a protones. Cada una de las llamadas reacciones redox desempeña un papel fundamental en la transferencia de energía biológica y se ha estudiado ampliamente para aplicaciones de producción y almacenamiento de energía.
Intermedios de reacción de ajuste fino electrostático
El estudio de la actividad catalítica de las tres [FeFe] hidrogenasas involucró una poderosa combinación de enfoques experimentales en numerosas instalaciones de investigación y fue realizado por científicos de WSU, NREL y ASU. Raugei, también designado conjuntamente en WSU, dirigió el equipo de modelado teórico y computacional, cuyo trabajo era ordenar las observaciones experimentales y desarrollar un modelo teórico para el mecanismo enzimático.
El equipo de investigación utilizó mediciones precisas de rayos X en la instalación de fuente de luz coherente de Linac, ubicado en la fuente de luz de radiación de sincrotrón de Stanford, analizar la estructura atómica de la enzima. Próximo, Los investigadores de ASU sometieron la enzima a una corriente eléctrica para examinar la actividad electrocatalítica de cada hidrogenasa tanto en estado de reposo como activo. Todas las enzimas compartían un grupo catalítico idéntico de átomos de hierro y azufre, generalmente llamado grupo H, pero diferían en la composición del entorno proteico circundante.
Los investigadores observaron diferencias significativas en el sesgo de reacción entre las tres hidrogenasas. Luego, durante los ciclos de retroalimentación entre los experimentos y el modelado computacional, los cambios sutiles en el campo electrostático alrededor del centro catalítico llamaron la atención del equipo.
"Vimos de hecho que si se cambiaba el campo, pudimos impulsar la reacción más favorablemente de una forma u otra para tratar de explicar la observación experimental, ", dijo Raugei. Las sutiles diferencias en el entorno, él dijo, determinó la dirección de la reacción en condiciones de estado estacionario y ajustó la velocidad de reacción.
Según King, la estabilización o desestabilización selectiva de intermedios catalíticos promovió preferentemente la oxidación de hidrógeno o la reducción de protones. Específicamente, un entorno más hidrofóbico que rodea al H-Cluster sintonizó la enzima para favorecer preferentemente la producción de hidrógeno, mientras que la oxidación del hidrógeno se vio favorecida por un entorno menos hidrófobo.
"Este trabajo, "dijo King, "revela el poder de la biología para controlar la reactividad de las metaloenzimas para cumplir con los procesos metabólicos únicos en toda la vida y proporciona una nueva información valiosa para el diseño de plataformas electrocatalíticas mejoradas".
Peters dijo que las características de diseño que usan las [FeFe] -hidrogenasas para ajustar y controlar la reactividad probablemente se compartan entre otros biocatalizadores de sitios metálicos. Los investigadores planean refinar su modelo para proporcionar un plan más general para comprender el sesgo catalítico en la clase más amplia de enzimas redox y la energía metabólica que impulsa toda la vida.