
Un nuevo estudio de la Universidad de Princeton y la Universidad Sapienza de Roma proporciona una fuerte evidencia de una controvertida teoría de que a temperaturas muy frías el agua puede existir en dos formas líquidas distintas, siendo uno menos denso y más estructurado que el otro. Crédito:Foto de John Salatas, Licencia Creative Commons
Agua, tan ordinario y tan esencial para la vida, actúa de formas que resultan bastante desconcertantes para los científicos. Por ejemplo, ¿Por qué el hielo es menos denso que el agua? flotando en lugar de hundirse como lo hacen otros líquidos cuando se congelan?
Ahora, un nuevo estudio proporciona una fuerte evidencia de una controvertida teoría de que a temperaturas muy frías el agua puede existir en dos formas líquidas distintas, siendo uno menos denso y más estructurado que el otro.
Investigadores de la Universidad de Princeton y la Universidad Sapienza de Roma realizaron simulaciones por computadora de moléculas de agua para descubrir el punto crítico en el que una fase líquida se transforma en la otra. El estudio fue publicado esta semana en la revista Ciencias .
"La presencia del punto crítico proporciona una explicación muy simple de las rarezas del agua, "dijo el Decano de Investigación de Princeton, Pablo Debenedetti, el Profesor de Ingeniería y Ciencias Aplicadas de la Clase de 1950, y profesor de ingeniería química y biológica. "Encontrar el punto crítico equivale a encontrar un bien, explicación simple de las muchas cosas que hacen que el agua sea extraña, especialmente a bajas temperaturas ".
Las rarezas del agua incluyen que cuando el agua se enfría, se expande en lugar de contraerse, por eso el agua congelada es menos densa que el agua líquida. El agua también se vuelve más comprimible o comprimible a temperaturas más bajas. También hay al menos 17 formas en que sus moléculas pueden organizarse cuando se congelan.
Un punto crítico es un valor único de temperatura y presión en el que dos fases de la materia se vuelven indistinguibles, y ocurre justo antes de que la materia se transforme de una fase a otra.
Las rarezas del agua se explican fácilmente por la presencia de un punto crítico, Debenedetti dijo. La presencia de un punto crítico se siente en las propiedades de la sustancia bastante lejos del punto crítico en sí. En el punto crítico, la compresibilidad y otras medidas termodinámicas de cómo se comportan las moléculas, como la capacidad calorífica, son infinitos.
Utilizando dos métodos computacionales diferentes y dos modelos informáticos de agua altamente realistas, el equipo identificó que el punto crítico líquido-líquido se encuentra en un rango de aproximadamente 190 a 170 grados Kelvin (aproximadamente -117 grados a -153 grados Fahrenheit) en aproximadamente 2, 000 veces la presión atmosférica al nivel del mar.
La detección del punto crítico es un paso satisfactorio para los investigadores involucrados en la búsqueda de décadas para determinar la explicación física subyacente de las propiedades inusuales del agua. Hace varias décadas, Los físicos teorizaron que enfriar el agua a temperaturas por debajo de su punto de congelación mientras la mantiene como un líquido, un estado "sobreenfriado" que ocurre en las nubes a gran altitud, expondría las dos formas líquidas únicas del agua a presiones suficientemente altas.
Para probar la teoría, los investigadores recurrieron a las simulaciones por ordenador. Los experimentos con moléculas de agua de la vida real no han proporcionado hasta ahora evidencia inequívoca de un punto crítico, en parte debido a la tendencia del agua sobreenfriada a congelarse rápidamente en hielo.
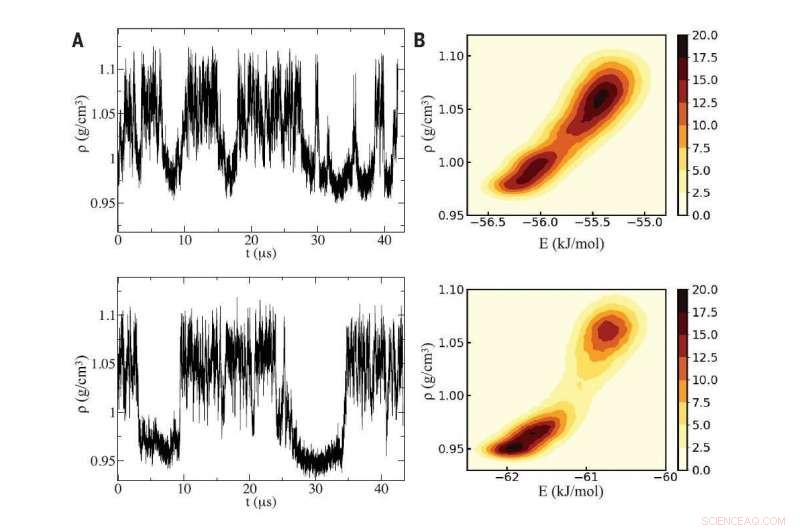
Fig A (izquierda):Usando dos simulaciones de computadora distintas del agua (paneles superior e inferior), Los investigadores detectaron cambios en la densidad característicos del agua sobreenfriada que oscila entre dos fases líquidas que difieren en densidad. Fig B (derecha):Las simulaciones revelaron un punto crítico entre las dos fases líquidas, cuyas diferentes densidades se originan microscópicamente en la intrusión de una molécula de agua extra en el entorno local de una molécula central genérica en el líquido de alta densidad. Crédito:Reimpreso con permiso de PG Debenedetti et al, Ciencias Vol 369 Edición 6501, DOI:10.1126 / science.abb9796
Francesco Sciortino, profesor de física en la Universidad Sapienza de Roma, realizó uno de los primeros estudios de modelización de este tipo mientras era investigador postdoctoral en 1992. Ese estudio, publicado en la revista Naturaleza , fue el primero en sugerir la existencia de un punto crítico entre las dos formas líquidas.
El nuevo hallazgo es extremadamente satisfactorio para Sciortino, quien también es coautor del nuevo estudio en Ciencias . El nuevo estudio utilizó computadoras de investigación mucho más rápidas y potentes de hoy en día y modelos de agua más nuevos y precisos. Incluso con las potentes computadoras de investigación de hoy en día, las simulaciones tomaron aproximadamente 1,5 años de tiempo de cálculo.
"Puede imaginarse la alegría cuando comenzamos a ver las fluctuaciones críticas comportándose exactamente como se suponía que debían hacerlo, "Dijo Sciortino." Ahora puedo dormir bien, porque después de 25 años, mi idea original ha sido confirmada ".
En el caso de las dos formas líquidas de agua, las dos fases coexisten en un equilibrio incómodo a temperaturas bajo cero y a presiones suficientemente altas. A medida que baja la temperatura, las dos fases líquidas se involucran en un tira y afloja hasta que una gana y todo el líquido se vuelve de baja densidad.
En las simulaciones realizadas por el investigador postdoctoral Gül Zerze en Princeton y Sciortino en Roma, a medida que bajaron la temperatura muy por debajo del punto de congelación en el rango de superenfriamiento, la densidad del agua fluctuó enormemente tal como se predijo.
Es probable que algunos de los comportamientos extraños del agua estén detrás de las propiedades vivificantes del agua, Dijo Zerze. "El fluido de la vida es el agua, pero todavía no sabemos exactamente por qué el agua no es reemplazable por otro líquido. Creemos que la razón tiene que ver con el comportamiento anormal del agua. Otros líquidos no muestran esos comportamientos, por lo que esto debe estar relacionado con el agua como el líquido de la vida ".
Las dos fases del agua ocurren porque la forma de la molécula de agua puede conducir a dos formas de empaquetamiento. En el líquido de menor densidad, cuatro moléculas se agrupan alrededor de una quinta molécula central en una forma geométrica llamada tetraedro. En el líquido de mayor densidad, una sexta molécula se aprieta, lo que tiene el efecto de aumentar la densidad local.
El equipo detectó el punto crítico en dos modelos informáticos de agua diferentes. Para cada modelo, los investigadores sometieron las moléculas de agua a dos enfoques computacionales diferentes para buscar el punto crítico. Ambos enfoques arrojaron el hallazgo de un punto crítico.
Peter Poole, profesor de física en la Universidad St. Francis Xavier en Canadá, y estudiante de posgrado cuando colaboró con Sciortino y fue coautor del artículo de 1992 en Nature, dijo que el resultado fue satisfactorio. "Es muy reconfortante tener este nuevo resultado, ", dijo." Ha sido una espera larga ya veces solitaria desde 1992 para ver otro caso inequívoco de una transición de fase líquido-líquido en un modelo de agua realista ".
C. Austen Angell, Profesor de Regents en la Universidad Estatal de Arizona, es uno de los pioneros de los experimentos en la década de 1970 sobre la naturaleza del agua sobreenfriada. "No hay duda de que este es un esfuerzo heroico en la simulación de la física del agua con una muy interesante, y bienvenido, conclusión, "dijo Angell, que no participó en el presente estudio, en un correo electrónico. "Como experimentalista con acceso a mediciones físicas de equilibrio (a largo plazo) en agua real, Siempre me había sentido "a salvo" de la apropiación por parte de los simuladores de computadora. Pero los datos presentados en el nuevo documento muestran que esto ya no es cierto ".