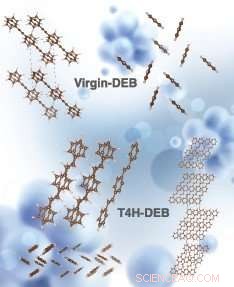
Estructuras cristalinas simuladas de virgin-DEB y T4H-DEB (químicamente conocido como 1, 4-distyrylbenzene, un isómero trans del producto intermedio DEB después de la captura de los primeros 4 átomos de hidrógeno con 2 enlaces CH en lados opuestos de la cadena de carbono). Las estructuras superior izquierda y superior derecha corresponden a la vista lateral y superior del DEB virgen, respectivamente. El medio a la derecha Las estructuras inferior derecha e inferior izquierda corresponden a la vista lateral, vista superior y una celda unitaria (vista lateral) de T4H-DEB, respectivamente. Crédito:La simulación fue realizada por Hom Sharma. La representación artística de la imagen fue realizada por Alexandria Holmberg Díaz, Laboratorio Nacional Lawrence Livermore.
El exceso de hidrógeno puede causar problemas en una variedad de industrias. Puede corroer semiconductores, electrónica, y combustible nuclear almacenado. También presenta un riesgo de explosión. Para eliminar este hidrógeno adicional, Los químicos pueden usar un compuesto orgánico llamado absorbente de hidrógeno que se une químicamente a varios átomos de hidrógeno.
Pero a veces, durante este proceso de unión, llamado hidrogenación catalítica, los productos parcialmente hidrogenados se vuelven volátiles, fundiéndose y evaporándose antes de que puedan unirse a más átomos de hidrógeno. Ahora, Los investigadores han explorado cómo y por qué varía esta volatilidad durante la hidrogenación, lo que sugiere que un efecto previamente subestimado de los enlaces carbono-hidrógeno en la molécula es el principal culpable.
El nuevo análisis, publicado en el Revista de física química , puede ayudar a los químicos a identificar las condiciones ideales necesarias para la hidrogenación catalítica para que puedan eliminar mejor el exceso de hidrógeno.
"Esto crea un modelo para el comportamiento de otros captadores orgánicos, permitiéndonos predecir sus temperaturas y entornos óptimos de funcionamiento, "dijo Long Dinh, físico del Laboratorio Nacional Lawrence Livermore.
Dinh y sus colegas se centraron en un captador llamado 1, 4 bis (feniletinil) benceno, o DEB. Para eliminar el hidrógeno, las escamas de cristal de DEB se mezclan con catalizadores en forma de gránulos sólidos. Los gránulos están hechos de carbón activado, cuya estructura porosa proporciona una superficie abundante, recubiertos con nanopartículas de paladio. El catalizador de paladio divide las moléculas de hidrógeno en átomos de hidrógeno, que luego puede unirse a DEB y formar enlaces carbono-hidrógeno.
DEB es un captador de alta capacidad, capaz de unirse con hasta ocho átomos de hidrógeno. La mayoría de los investigadores pensaron que a medida que los captadores como DEB se unen con más átomos de hidrógeno y se agrandan, se vuelven más volátiles. A altas temperaturas de funcionamiento, luego pueden evaporarse, alejándose de los gránulos catalíticos donde no hay átomos de hidrógeno con los que unirse. "Detienes el proceso de hidrogenación prematuramente, "Dijo Dinh.
Pero los investigadores encontraron que en los dos primeros pasos de la hidrogenación, cuando DEB forma dos enlaces carbono-hidrógeno por paso (los enlaces carbono-hidrógeno se crean en lados opuestos de la cadena de carbono de la molécula), la molécula en realidad disminuye en volatilidad. Solo en las siguientes etapas de hidrogenación el DEB se vuelve más volátil.
Para estudiar cómo y por qué la DEB cambia en volatilidad, los investigadores midieron propiedades como la presión de vapor y los puntos de fusión, estructura molecular probada, y ejecutó simulaciones por computadora de mecánica cuántica para modelar el proceso de hidrogenación. Su análisis sugiere que los enlaces carbono-hidrógeno en DEB juegan un papel clave en el comportamiento volátil de la molécula.
Durante la hidrogenación, el hidrógeno se une a los átomos de carbono en DEB. Según el pensamiento convencional, el enlace carbono-hidrógeno resultante es no polar:ninguno de los extremos de la estructura de barra tiene una carga más negativa o positiva que el otro. Pero resulta que el extremo de carbono es un poco más negativo, y el enlace carbono-hidrógeno forma un dipolo débil, Dinh explicó.
Como dipolo, un enlace carbono-hidrógeno puede atraer o repeler otros enlaces carbono-hidrógeno en otras moléculas DEB. Dependiendo de cómo se organizan los enlaces carbono-hidrógeno y cuántos hay en los productos DEB intermedios, las moléculas pueden atraerse o repelerse entre sí, y por tanto ser menos o más volátil, respectivamente. Investigaciones anteriores habían pasado por alto estas interacciones colectivas entre los enlaces carbono-hidrógeno en cristales orgánicos, Dijo Dinh.
De su análisis, los investigadores determinaron que las condiciones óptimas para la hidrogenación DEB están por debajo de unos 175 grados Fahrenheit, si se hace en un buen vacío. "Nuestros resultados, "Dinh dijo, "También se puede aplicar de forma análoga a otros sistemas catalíticos de obtención de hidrógeno orgánico".