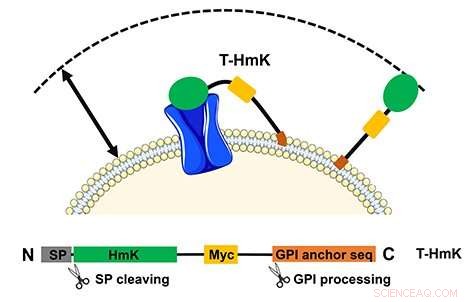
La toxina atada (T-HmK) se libera y se une a un canal de potasio (azul) expresado en la membrana celular. El volumen de reacción que puede visitar una T-HmK (flecha de dos puntas) está determinado por las longitudes combinadas del enlazador de péptido flexible, el ancla de GPI, y el diámetro de la toxina HmK. El panel inferior muestra el diseño del constructo de expresión. Crédito:Facultad de Medicina de la UCI
En el pasado, Los péptidos biológicamente activos (pequeñas proteínas como neurotoxinas y hormonas que actúan sobre los receptores celulares para alterar la fisiología) se purificaron a partir de fuentes nativas como venenos y luego se produjeron paneles de variantes en bacterias. o sintetizado, estudiar la base estructural de la interacción del receptor. Una nueva técnica llamada escaneo zombie hace que estos procesos más antiguos sean obsoletos.
Los péptidos se utilizan para terapia médica y para estudiar biología. entre otras cosas, pero su coste de producción en tiempo y dinero es cada vez más elevado.
"Si un péptido tiene 30 residuos, simplemente cambiar cada sitio una vez requiere la síntesis, purificación y validación de la composición plegada de las 30 variantes, un proceso que requiere meses y muchos miles de dólares, "dijo Steven A.N. Goldstein, MARYLAND, Doctor., vicerrector de Asuntos de Salud de la Universidad de California, Irvine, y profesor distinguido en los Departamentos de Pediatría y Fisiología y Biofísica de la Facultad de Medicina de la UCI.
Publicado hoy en Avances de la ciencia , el nuevo estudio codirigido por Goldstein y Jordan H. Chill, Doctor., profesor del Departamento de Química de la Universidad Bar-Ilan de Israel, revela cómo los investigadores fueron capaces de secuestrar la maquinaria celular para simplificar la creación de péptidos permitiendo una amplia, Estudios rápidos de estructura-función y mecanismo para mejorar la especificidad y afinidad de acción, los parámetros importantes para la eficacia terapéutica.
"Dado que secuestramos la maquinaria celular para sintetizar y mostrar los péptidos en la superficie celular con el receptor, llamamos a este escaneo de zombies, "dijo el primer autor Ruiming Zhao, Doctor., investigador del laboratorio Goldstein.
"Con esta nueva técnica, Los cambios de péptidos son tan simples como la síntesis de plásmidos y solo requieren días de trabajo y centavos por construcción. Esto nos permite estudiar las funciones de muchos sitios con muchos cambios en un período de tiempo mucho más corto a un costo mucho menor ".
El estudio, noble, "Las neurotoxinas de péptidos anclados muestran dos mecanismos de bloqueo en el poro del canal de K + al igual que sus análogos libres, "describe cómo los péptidos codificados se unen a través de una vía nativa al exterior de la célula en una atadura flexible. En este caso, la diana del receptor también se expresó a partir de un plásmido y podría modificarse. El método también permite el estudio de interacciones de baja afinidad que de otro modo no serían factibles de analizar.
Usando escaneo de zombies, Los investigadores hicieron el descubrimiento inesperado de que un péptido en ensayos clínicos como inmunosupresor actúa de manera diferente a lo que se pensaba, revelando que esta familia de neurotoxinas tiene dos modos posibles de interactuar con los canales de potasio en lugar de uno solo.
Chill y su colega Netanel Mendelman, Doctor., mejoró el impacto de estos hallazgos al dilucidar la estructura tridimensional de una neurotoxina seleccionada usando resonancia magnética nuclear (RMN).
"Al estimar cientos de distancias y ángulos entre átomos en el péptido, ahora conocemos su estructura, ofreciendo un contexto molecular para estos emocionantes resultados, ", dijo Chill." Los dos modos de unión parecen implicar un 'cambio' de la toxina o algún reordenamiento de su estructura atómica ".
Los modos de unión alternativos descritos para estos péptidos son un factor de confusión problemático en el diseño de fármacos basado en la estructura. destacando la importancia de los hallazgos de este informe y los estudios futuros del proceso de reconocimiento entre canales y péptidos inhibidores.