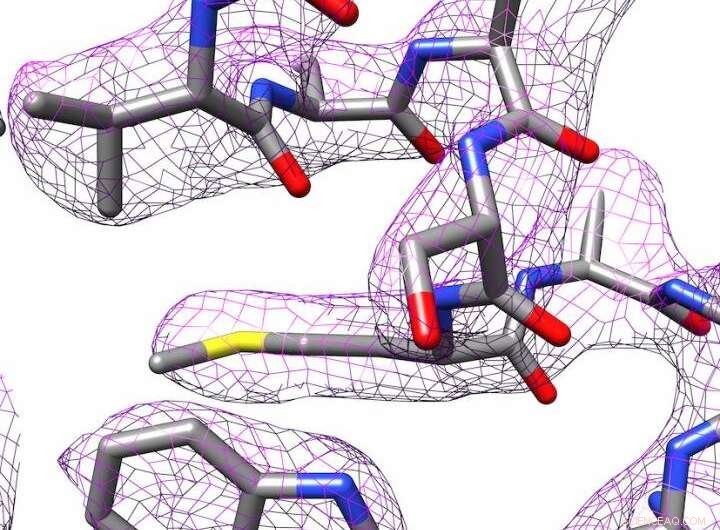
Estructura 3D de la apoferritina producida por crio-microscopía electrónica. Crédito:Panagiotis Kastritis
Los bioquímicos de la Universidad Martin Luther de Halle-Wittenberg (MLU) han utilizado un crio-microscopio electrónico estándar para lograr imágenes sorprendentemente buenas que están a la par con las tomadas con equipos mucho más sofisticados. Han logrado determinar la estructura de la ferritina casi a nivel atómico. Sus resultados fueron publicados en la revista MÁS UNO .
La crio-microscopía electrónica se ha vuelto cada vez más importante en los últimos años, especialmente para arrojar luz sobre las estructuras de las proteínas. Los desarrolladores de la nueva tecnología recibieron el Premio Nobel de Química en 2017. El truco:las muestras se congelan instantáneamente y luego se bombardean con electrones. En el caso de la microscopía electrónica tradicional, primero se extrae toda el agua de la muestra. Esto es necesario porque la investigación se lleva a cabo en el vacío, lo que significa que el agua se evaporaría inmediatamente y haría imposible la obtención de imágenes.
Sin embargo, debido a que las moléculas de agua juegan un papel tan importante en las biomoléculas, especialmente en proteínas, no se pueden examinar con microscopía electrónica tradicional. Las proteínas se encuentran entre los bloques de construcción más importantes de las células y realizan una variedad de tareas. Es necesario un conocimiento profundo de su estructura para comprender cómo funcionan.
El grupo de investigación dirigido por el Dr. Panagiotis Kastritis, quien es líder de grupo en el Centro de Competencia en Innovación HALOmem y profesor junior en el Instituto de Bioquímica y Biotecnología en MLU, adquirió un crio-microscopio electrónico de última generación en 2019. "No hay otro microscopio como este en Halle, "dice Kastritis. El nuevo Thermo Fisher Glacios 200 kV, financiado por el Ministerio Federal de Educación e Investigación, no es el mejor y más caro microscopio de su tipo.
Sin embargo, Kastritis y sus colegas lograron determinar la estructura de la proteína de almacenamiento de hierro apoferritina hasta 2,7 ångströms (Å), en otras palabras, casi hasta el átomo individual. Un ångström equivale a una décima parte de un nanómetro. Esto coloca al grupo de investigación en una liga similar a los departamentos con equipos mucho más costosos. La apoferritina se utiliza a menudo como proteína de referencia para determinar los niveles de rendimiento de los microscopios correspondientes.
Hace poco, dos grupos de investigación batieron un nuevo récord con una resolución de aproximadamente 1,2 Å. "Estos valores solo pueden lograrse con instrumentos muy potentes, que solo un puñado de grupos de investigación de todo el mundo tiene a su disposición. Nuestro método está diseñado para microscopios que se encuentran en muchos laboratorios, "explica Kastritis.
Los crio-microscopios electrónicos son dispositivos muy complejos. "Incluso las pequeñas desalineaciones pueden inutilizar las imágenes, ", dice Kastritis. Es importante programarlos correctamente y Halle tiene la experiencia técnica para hacerlo. Pero el análisis que se realiza después de que se han recopilado los datos es igualmente importante". El microscopio produce varios miles de imágenes, "explica Kastritis.
Los programas de procesamiento de imágenes se utilizan para crear una estructura tridimensional de la molécula. En cooperación con el profesor Milton T. Stubbs del Instituto de Bioquímica y Biotecnología de MLU, los investigadores han desarrollado un nuevo método para crear un modelo de alta resolución de una proteína. El grupo de investigación de Stubbs utiliza cristalografía de rayos X, otra técnica para determinar la estructura de proteínas, lo que requiere la cristalización de las proteínas. Pudieron combinar una forma modificada de una técnica de análisis de imágenes con las imágenes tomadas con el crio-microscopio electrónico. Esto hizo visibles los estados de carga y las moléculas de agua individuales.
"Es un método atractivo, "dice Kastritis. En lugar de necesitar microscopios muy caros, se requiere mucha capacidad informática, que tiene MLU. Ahora, además de utilizar cristalografía de rayos X, La crio-microscopía electrónica se puede utilizar para producir imágenes de proteínas, especialmente aquellas que son difíciles de cristalizar. Esto permite la colaboración, tanto dentro como fuera de la universidad, sobre el análisis estructural de muestras con potencial médico y biotecnológico.