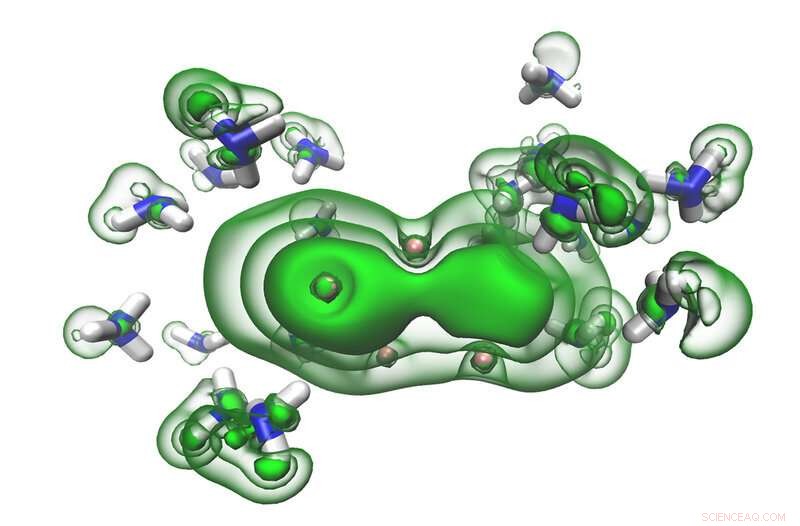
Los electrones solvatados (verdes) en los espacios entre las moléculas de amoníaco (azul y blanco) comienzan a fusionarse en un par a medida que una solución se vuelve metálica. Crédito:Ryan McMullen
Ryan McMullen nunca había oído hablar del Colegio de Letras de USC Dornsife, Artes y Ciencias cuando comenzó a buscar un programa de posgrado en química. Pero por recomendación de uno de sus profesores, envió un correo electrónico al profesor de química de la universidad, Stephen Bradforth, proponiendo un experimento para descubrir qué hace que un metal sea realmente un metal.
La propuesta no solo se convertiría en su doctorado. tesis sino un gran avance científico.
La propuesta de McMullen no fue fácil de vender. El experimento sería caro y posiblemente peligroso.
Los académicos con los que McMullen se puso en contacto en otras universidades de investigación de EE. UU. Le dijeron que tenían fondos para su propia investigación, pero no por el suyo. Pero Bradforth tuvo una respuesta diferente.
"Él dijo, 'No tengo fondos para tu idea, pero si vienes aquí podemos escribir una propuesta de financiamiento juntos, '", dijo McMullen, quien en ese momento estaba terminando sus estudios de pregrado en la Universidad de Bristol en el Reino Unido.
Bradforth no solo ayudó a McMullen a obtener fondos, priorizarlo para el apoyo de la National Science Foundation sobre la continuación de otros proyectos, pero también improvisó un equipo internacional de científicos y organizó su año sabático para supervisar y participar en los principales experimentos. También se convirtió en Ph.D. de McMullen. asesor.
Bradforth reconfiguró su laboratorio para proteger a sus científicos. El experimento requirió amoníaco líquido, que puede ser levemente tóxico, y metal alcalino, que puede explotar si toca el agua.
"Mi laboratorio se ve diferente debido a esto, "señaló Bradforth, quien también es decano divisional de ciencias naturales y matemáticas.
El esfuerzo valió la pena el resultado. El experimento descubrió hallazgos que son "el tipo de cosas que aparecen en los libros de texto, o al menos cambia la forma en que se escriben los libros de texto, "Bradforth dijo, señalando la importancia potencialmente histórica del trabajo. También ganaría la codiciada distinción de ser la portada del 5 de junio de la revista Science.
Yendo a todo metal
El proyecto analizó una pregunta fundamental:¿Qué propiedades son inherentes a un metal y cuáles son accesorias?
La intuición sugiere que los metales son densos, y si bien eso es cierto para algunos (piense en oro o plomo), no aguanta a los demás. Por ejemplo, el litio, comúnmente utilizado en baterías, flota en el agua. Algunos metales son duros como el titanio, otros ceden fácilmente a la presión, incluyendo indio y aluminio. ¿Qué tal la temperatura de fusión? El platino se derrite a más de 1, 700 grados Celsius (3, 200 F), pero el mercurio es un líquido muy por debajo de cero.
Muchas otras definiciones de 'campana de metal' sufren contradicciones similares, pero solo los metales pueden conducir la electricidad. Conducción, a diferencia de la densidad o dureza, es una propiedad inherente de todos los metales.
Buscando comprender mejor las propiedades intrínsecas de los metales, Bradforth, McMullen y sus colegas utilizaron un truco observado por primera vez por el químico Sir Humphry Davy en 1809. En esencia, hicieron un metal desde cero.
Los científicos enfriaron amoníaco, normalmente un gas a temperatura ambiente, a menos 33 C para licuarlo y luego agregaron:en experimentos separados, el litio de los metales alcalinos, sodio y potasio.
En estas soluciones, los electrones del metal alcalino quedan atrapados inicialmente en los espacios entre las moléculas de amoníaco. Esto crea lo que los científicos llaman 'electrones solvatados, 'que son altamente reactivos pero estabilizados en el amoníaco. Estas soluciones tienen un color azul característico. Pero dados suficientes electrones solvatados, todo el líquido se vuelve bronce y, en esencia, se convierte en metal sin dejar de ser líquido.
Los electrones solvatados han demostrado ser importantes para los químicos orgánicos. A través de una reacción llamada "Reducción de abedul, "llamado así por el químico Arthur Birch, fueron clave para sintetizar muchos compuestos importantes y llevaron a la fabricación de anticonceptivos orales en la década de 1950.
Radiando en electrones
A continuación, los científicos midieron la cantidad de energía necesaria para extraer los electrones solvatados del amoníaco metálico utilizando un haz de rayos X extremadamente brillante y enfocado con base en Berlín.
En un primer experimento, Forzaron diferentes concentraciones del amoniaco metálico a través de un microjet, que creaba una corriente del ancho de un cabello humano que luego pasaba a través de un haz de rayos X delgado como un cabello.
Los resultados mostraron que, a bajas concentraciones, los electrones solvatados se desalojaron más fácilmente de la solución por la interacción con los rayos X, dando un patrón de energía simple. En concentraciones más altas, aunque, el patrón de energía de repente desarrolló un borde de banda afilado, indicando que la solución se estaba comportando como lo haría un metal.
Si bien las implicaciones prácticas del resultado necesitan más investigación, el experimento abre una nueva ventana para que los químicos sinteticen importantes compuestos orgánicos. Así como la reducción de Birch llevó a los anticonceptivos orales, asi que, también, ¿Podría este experimento conducir a nuevos compuestos para su uso de innumerables formas?
Jersey chico
McMullen, un nativo de Jersey (el original europeo, no el estado vecino de Nueva York), planea regresar a su laboratorio en USC Dornsife dentro de unas semanas. Pero no ha dejado que la pandemia de COVID-19 lo frene. Siempre curioso sobre cómo funciona la electrónica, ha estado llevando a cabo experimentos, de forma segura, por supuesto, desde su apartamento en Long Beach, California, utilizando componentes que compró en e-Bay.
Después de completar su doctorado, McMullen, el primero en su familia en asistir a la universidad, planea realizar una beca postdoctoral, aunque no está seguro de dónde o en qué se concentrará. El lo sabe sin embargo, que quiere permanecer en la academia. Dondequiera que aterrice, es casi seguro que el mundo de la química volverá a tener noticias suyas.
"Me gusta hacer las cosas exóticas".