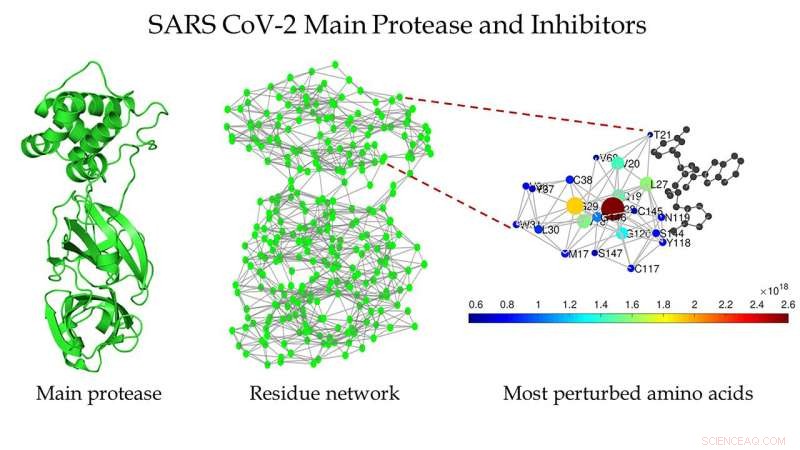
Esquema de la proteasa principal del SARS CoV-2 (izquierda), la red de residuos de proteínas de la proteasa principal del SARS CoV-2 (centro), y una vista ampliada de la región alrededor del sitio de unión detectada por Estrada (derecha). Crédito:Ernesto Estrada
A medida que la pandemia de COVID-19 causada por el coronavirus SARS-CoV-2 continúa propagándose por todo el mundo, muchos investigadores están estudiando modelos epidemiológicos para predecir su propagación.
Sin embargo, Ernesto Estrada, matemático y experto en sistemas complejos de la Fundación ARAID de la Universidad de Zaragoza, decidió centrarse en encontrar objetivos dentro del SARS-CoV-2 para atacar con nuevos fármacos. De trabajos anteriores, sabía que la principal proteasa del virus, una enzima encargada del procesamiento proteolítico de poliproteínas, es un excelente objetivo.
En el diario Caos , Estrada dijo que cuando él y sus colegas descubrieron un aumento dramático en la sensibilidad de la proteasa principal del SARS-CoV-2 a pequeñas alteraciones, les hizo sospechar que los inhibidores desempeñan un papel en la eliminación del virus.
Los inhibidores son moléculas orgánicas, drogas o nuevos compuestos químicos que se adhieren al sitio de unión de una proteasa para inhibir su trabajo. Un virus morirá sin una enzima proteolítica que funcione para él.
"Noté que los químicos ya habían encontrado algunos inhibidores potentes de la proteasa principal del SARS-CoV-2, y que habían resuelto la estructura de esta proteína mediante cristalografía de rayos X, ", dijo." Fue impactante ver que esta proteasa es muy similar a la del coronavirus del SARS, que produjo las epidemias de 2003, SARS-CoV-1 ".
Cuando los investigadores superpusieron ambas estructuras una encima de la otra, coincidían casi a la perfección.
"Si alineas las secuencias de aminoácidos de ambas proteasas, solo hay 12 de 306 residuos que no coinciden, "Dijo Estrada." ¿Hay algo escondido detrás de estas aparentes similitudes entre las dos proteasas? ¿Podemos aprender algo de ellos para mejorar el diseño de medicamentos contra el virus? "
El grupo de Estrada tiene una amplia experiencia en el análisis de redes, como redes sociales, La Internet, o cadenas alimenticias entre especies dentro de un entorno, y decidió tratar una proteína como una red.
"Se llaman redes de residuos de proteínas, donde representamos cada aminoácido como un nodo, y la interacción entre dos aminoácidos está representada por un vínculo entre los dos, " él explicó.
Encontraron varias estructuras de la proteasa principal de SARS CoV-1 y SARS CoV-2 que estaban limpias, lo que significa que no contienen mutaciones, ligandos, o disolventes dentro de sus estructuras. Transformaron su estructura en redes de residuos de proteínas.
Estrada dijo que las medidas de red más tradicionales revelaron que ambas estructuras eran muy similares entre sí, algo que su equipo ya sabía. "Pero hace un par de años, Desarrollamos una medida matemática más sofisticada que nos permite detectar a qué distancia se puede propagar una perturbación dentro de una red. Ese trabajo fue de una forma muy teórica, naturaleza matemática, pero habíamos especulado que podría ser útil para el estudio de proteínas ".
Así que lo pusieron a prueba. Reveló que la proteasa de SARS-CoV-2 es 1, 900% más sensible a la transmisión de perturbaciones de largo alcance que la proteasa del SARS-CoV-1.
"Esto significa que cuando se perturba una proteína, por ejemplo, por agua dentro del ambiente intracelular, tales perturbaciones se transmiten a través de una red de intraresiduos que forman la estructura tridimensional de la proteína, "Dijo Estrada." Si tal perturbación se produce alrededor de un aminoácido dado dentro de la proteasa del SARS-CoV-1, se transmite sólo a través de un entorno cercano alrededor de ese aminoácido perturbado ".
Pero si esta perturbación le ocurre a un aminoácido dentro de la proteasa del SARS-CoV-2, se transmite a casi toda la red, incluso a aminoácidos muy lejanos.
"Es extraordinario, porque significa que con pequeñas diferencias estructurales, la proteasa del SARS-CoV-2 es mucho más efectiva dentro de las comunicaciones intraresiduos, ", Dijo Estrada." Debería ser mucho más eficaz en hacer su trabajo como una enzima proteolítica del virus. El diablo hizo un trabajo casi perfecto aquí pero dejó la puerta abierta. Esta gran sensibilidad de la proteasa SARS-CoV-2 a las perturbaciones puede ser su talón de Aquiles en relación con los inhibidores ".
El enfoque del grupo se puede utilizar para protocolos de detección masiva para identificar potentes inhibidores de la proteasa principal del SARS-CoV-2 y, como consecuencia, para el desarrollo de nuevas drogas para matarlo.