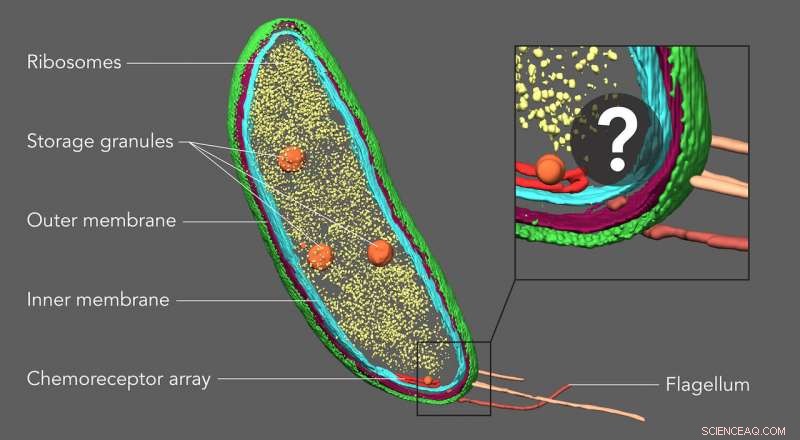
Los científicos de la Universidad de Stanford pensaron que un área aparentemente vacía en un extremo de la bacteria Caulobacter podría contener dos proteínas involucradas en la división celular. Al etiquetar las proteínas con etiquetas fluorescentes y luego obtener imágenes de esas mismas muestras con tomografía crioelectrónica, pudieron confirmar esta ubicación y mostrar exactamente cómo estaban dispuestas las proteínas. Crédito:Peter Dahlberg et al., PNAS , 8 de junio de 2020
Los científicos han combinado dos de las técnicas de microscopía más poderosas de la actualidad para crear imágenes que identifiquen, por primera vez, las identidades y ubicaciones precisas de proteínas individuales dentro del contexto detallado de las células bacterianas. Esta información es crucial para aprender cómo las moléculas de proteínas trabajan juntas para organizar la división celular y llevar a cabo otras tareas importantes. como permitir a los microbios olfatear alimentos y peligros.
El nuevo método ya ha desenterrado nueva información sobre las proteínas bacterianas y sus vecindarios celulares cercanos. Los investigadores dicen que también tiene potencial para responder preguntas fundamentales sobre la maquinaria molecular de los virus, parásitos y procesos como la fotosíntesis.
"Este es un gran salto para la biología, y creo que hay muchos, muchos sistemas que se beneficiarán de este tipo de imágenes, "dijo la profesora de Stanford Lucy Shapiro, cuyo grupo de investigación participó en el estudio.
El nuevo método híbrido, llamadas imágenes correlacionadas por anotación con moléculas individuales, o CIASM (pronunciado "abismo"), fue desarrollado por Peter Dahlberg, investigador postdoctoral en el laboratorio del profesor W. E. Moerner en la Universidad de Stanford.
Es una variación de una técnica llamada microscopía de molécula única a baja temperatura, inventado por Moerner hace tres décadas, que adhiere etiquetas brillantes a las moléculas para que puedan identificarse individualmente. Este método es la base de la microscopía de fluorescencia de superresolución, el tema del Premio Nobel de Química 2014 de Moerner.
Lo que hizo Dahlberg fue encontrar una manera de hacer que este tipo de imágenes de fluorescencia funcionara a temperaturas bajo cero, de modo que las mismas muestras también pudieran examinarse con tomografía electrónica criogénica (CET). CET utiliza corrientes de electrones para crear imágenes tridimensionales de células congeladas instantáneamente y sus componentes con una resolución casi atómica. La combinación de CET con las imágenes fluorescentes permite a los científicos ver las moléculas marcadas en el contexto de la célula circundante. una perspectiva crucial para comprender su papel en la maquinaria celular.
"Podemos etiquetar moléculas específicas de interés para que la luz que vemos provenga solo de esas moléculas, y luego encontramos dónde están dentro de unos 10 nanómetros, o mil millonésimas de metro. Esto nos da una imagen mucho más precisa de lo que está sucediendo, ", Dijo Dahlberg." Hemos tomado las instantáneas ultra precisas proporcionadas por CET y hemos agregado un poco de color ".
Él agregó, "Es emocionante desarrollar nuevos métodos de diagnóstico por imágenes. Cuando haya terminado, puedes dar un paso atrás y mirar todas las nuevas preguntas que puedes atacar ".
Con CIASM, El equipo de investigación pudo identificar la ubicación de tres tipos de proteínas en imágenes CET de alta resolución de bacterias tomadas en el Laboratorio Nacional Acelerador SLAC del Departamento de Energía. Los resultados se informaron en el procedimientos de la Academia Nacional de Ciencias hoy dia.
"Cada método tiene sus ventajas y desventajas, "Moerner dijo, "y esta es una buena situación en la que podemos combinar dos métodos para aprender más".
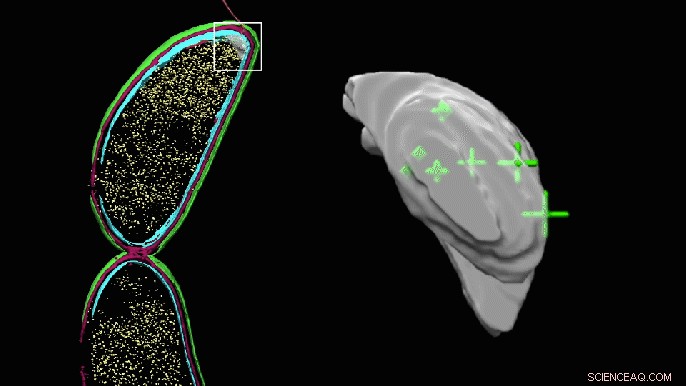
Una imagen en 3D giratoria del bolsillo aparentemente vacío en un extremo de una célula de Caulobacter ahora muestra las ubicaciones precisas de las moléculas PopZ. El bolsillo se ve abultado porque se ha coloreado manualmente para resaltar el área donde los investigadores pensaron que podrían estar las moléculas. pero no se pudo identificar directamente en la tomografía crioelectrónica. Crédito:Peter Dahlberg et al., PNAS , 8 de junio de 2020
Encontrar orden en una sopa celular
Incluso en células bacterianas relativamente simples, la ubicación lo es todo, dijo Saumya Saurabh, un investigador postdoctoral en el laboratorio de Shapiro que jugó un papel destacado en la investigación.
"La gente tiende a pensar en las bacterias como sacos de proteínas sin organización, ", dijo." Pero resulta que eso no es cierto, y, de hecho, muchas de las moléculas de las bacterias están ubicadas con precisión tanto en el espacio como en el tiempo. Si no están en la posición correcta, la celda muere. Lo que el trabajo de Pete finalmente nos permite hacer es mirar adentro con resolución molecular y descubrir cuándo y dónde se encuentran estas moléculas entre sí ".
Caulobacter crescentus, por ejemplo, una especie bien estudiada de bacterias de agua dulce, es conocido por dividirse en dos tipos muy diferentes de células hijas:uno nada libremente, mientras que el otro forma un tallo y se adhiere a una superficie. Cómo cada célula hija obtiene lo que necesita para seguir su camino único ha sido un misterio de larga data.
Los científicos habían identificado previamente áreas pequeñas en cada extremo de la célula en división que podrían contener proteínas que desempeñan un papel clave en esta división celular desequilibrada. Una de las proteínas PopZ, se encuentra en ambos extremos de la celda en división, mientras que el otro, SpmX ("Spam-X") se encuentra solo en la mitad que desarrollará un tallo.
Para este estudio, Saurabh y el estudiante de posgrado Jiarui Wang marcaron proteínas en Caulobacter con etiquetas fluorescentes. Luego Dahlberg congeló estas muestras, realizó imágenes de fluorescencia de una sola molécula en ellos con la ayuda de la estudiante graduada Annina Sartor, y los llevó a las instalaciones de Stanford-SLAC Cryo-EM para obtener imágenes CET dirigidas por Wah Chiu, profesor en Stanford y SLAC.
Mapeo de un lugar de reunión de proteínas
Las imágenes combinadas no solo confirmaron que ambas proteínas estaban en las áreas que los científicos habían sospechado, pero también reveló exactamente cómo estaban dispuestos:SpmX estaba incrustado en la membrana interna de la célula y sobresalía hacia el interior de la célula, donde entró en contacto directo con PopZ.
"La orientación exacta de este complejo proteico se ha debatido durante los últimos 12 años, ", Dijo Saurabh." Pudimos observar las proteínas asociadas con una resolución exquisita. Ahora tenemos una imagen muy precisa de cómo estas proteínas se comunican entre sí en la célula ".
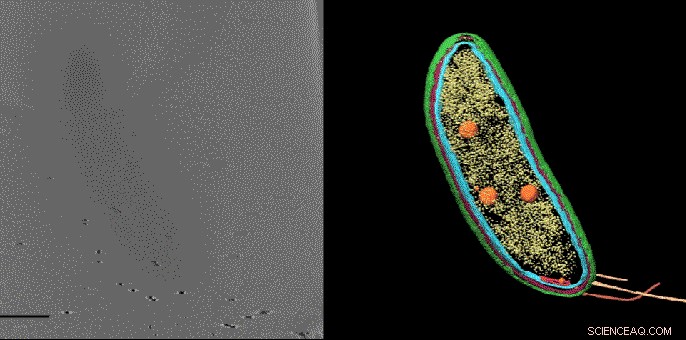
Con una técnica llamada tomografía crioelectrónica, los científicos pueden crear imágenes detalladas en 3D de las células, como esta bacteria Caulobacter, y resaltar sus componentes, en este caso, las membranas celulares (rojo y azul), cáscara de proteína (verde), fábricas de proteínas conocidas como ribosomas (amarillo) y gránulos de almacenamiento (naranja). Pero hasta ahora Las estructuras más pequeñas y las moléculas individuales no pudieron identificarse y ubicarse con precisión dentro de estas imágenes. Una nueva técnica de imágenes desarrollada en Stanford llena este vacío, revelando pequeñas moléculas que no son visibles aquí. Crédito:Peter Dahlberg et al., PNAS , 8 de junio de 2020
El equipo probó la precisión de CIASM usándolo para confirmar la ubicación de una proteína llamada McpA que se sabía que era parte de una matriz de quimiorreceptores en las bacterias. "Las proteínas exquisitamente sensibles de esta matriz sirven como nariz de Caulobacter, "Saurabh dijo, "sintiendo la química del ambiente circundante para que puedan alejarse de cosas desagradables y moverse hacia la glucosa que ingieren".
La matriz aparece como líneas negras paralelas en las imágenes CET, y el etiquetado fluorescente de las mismas imágenes señaló las ubicaciones de las proteínas McpA individuales dentro de aproximadamente 10 nanómetros.
Una mirada detallada a los puntos cuánticos
En una separada, estudio paralelo, publicado el 24 de abril en Angewandte Chemie , los investigadores utilizaron una técnica similar para observar puntos cuánticos individuales, con unos resultados sorprendentes.
Los puntos cuánticos son cristales a nanoescala de material semiconductor que fluorescen naturalmente en colores determinados por su tamaño. forma y composición. Estos puntos se utilizan en la investigación para etiquetar y rastrear proteínas y otros materiales biológicos, y tener aplicaciones potenciales en la electrónica del futuro, Encendiendo, computación cuántica, imágenes médicas y otras áreas.
En este estudio, el objetivo era ver cómo los detalles estructurales más finos de los puntos individuales se relacionaban con detalles específicos de sus propiedades ópticas, dijo Davis Perez, un doctorado estudiante en el laboratorio de Moerner.
"Pudimos ver algunos comportamientos sorprendentes de los puntos cuánticos individuales, por ejemplo, en su respuesta a la excitación con luz láser, ", dijo." Pero el aspecto más emocionante para mí es que el método que desarrollamos para estudiar puntos cuánticos también se puede utilizar para estudiar sistemas biológicos como las proteínas fotosintéticas, donde la energía se transfiere entre grupos de proteínas, y ver cómo funciona la maquinaria fotosintética ".
Moerner dijo que su laboratorio está trabajando con Chiu para perseguir estos desafíos.
"Son los primeros días de combinar los dos métodos, y estamos emocionados de explorar más colaboraciones que vinculen la luz y los electrones, ", Dijo Chiu." Este enfoque de imágenes híbridas tiene el potencial de descubrir estructuras de componentes moleculares involucrados en procesos biológicos clave en células que abarcan todos los dominios de la vida ".