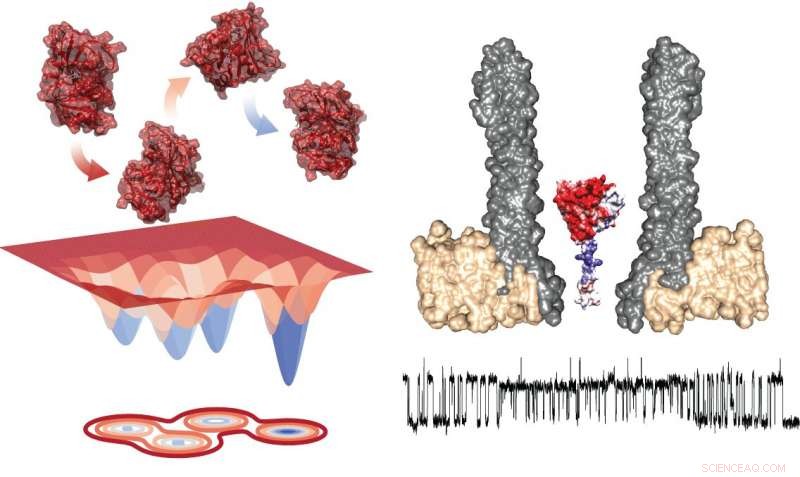
Diagrama de energía de los cuatro confórmeros (izquierda) y la configuración experimental que muestra el nanoporo con la enzima atrapada en sección transversal (derecha). Debajo, hay una traza típica que muestra las mediciones durante el intercambio dentro de los rotámeros. Crédito:Giovanni Maglia, Universidad de Groningen
Los científicos de la Universidad de Groningen han observado las características de una sola enzima dentro de un nanoporo. Aprendieron que la enzima puede existir en cuatro estados plegados diferentes, o conformadores, que juegan un papel activo en el mecanismo de reacción. Estos resultados tendrán consecuencias para la ingeniería enzimática y el desarrollo de inhibidores. El estudio fue publicado en Química de la naturaleza el 6 de abril.
Las enzimas son proteínas plegadas que tienen una estructura tridimensional específica que crea un sitio activo que puede unirse a un sustrato y catalizar una reacción específica. En años recientes, ha quedado claro que las enzimas no son estructuras rígidas, pero que las proteínas plegadas existen como un conjunto de conformaciones en equilibrio alrededor de un estado fundamental energéticamente estable.
Túnel de viento
Estudiar la transición entre estados requiere observar enzimas individuales durante un período prolongado de tiempo, que es desafiante. El profesor asociado de biología química de la Universidad de Groningen, Giovanni Maglia, desarrolló nanoporos en forma de embudo que pueden atrapar proteínas. Al medir la corriente iónica a través de un nanoporo incrustado en una membrana lipídica artificial, Maglia pudo observar cambios conformacionales en enzimas. "Se puede comparar con estudiar un automóvil en un túnel de viento, "explica." Abrir una ventana o una puerta cambiará el flujo de aire. En una forma similar, un cambio en la estructura de plegado de la enzima cambia la corriente iónica a través del poro ".
Maglia utilizó su sistema de nanoporos para estudiar la enzima dihidrofolato reductasa (DHFR), que convierte el dihidrofolato en tetrahidrofolato. "Elegimos esta enzima porque se ha estudiado como un sistema modelo para la dinámica enzimática durante más de 30 años, utilizando todas las técnicas disponibles. Además, inhibidores de esta enzima, como el metotrexato, se utilizan como medicamentos contra el cáncer.
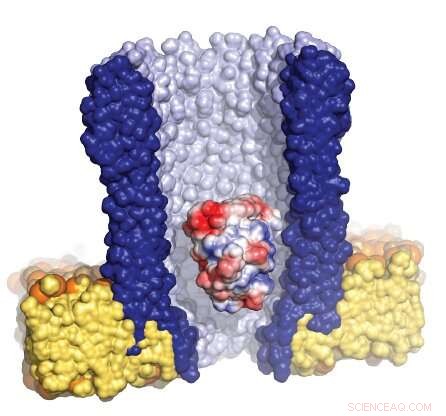
Ilustración del nanoporo en forma de embudo (azul) rodeado por la membrana artificial (amarillo), con una sola enzima (roja / blanca / azul) atrapada dentro del poro. Crédito:Giovanni Maglia, Universidad de Groningen
Liberación eficiente
Las mediciones de DHFR revelaron la presencia de cuatro confórmeros con diferentes afinidades por los sustratos. Maglia dice:"El cambio entre estos cuatro estados fue muy lento. Esto significa que solo se pueden ver en este tipo de estudios de una sola enzima de larga duración".
Añadiendo el inhibidor de la reacción metotrexato, que se une a la enzima, provocó una transición muy rápida entre estados y cambió la afinidad de las enzimas. "Nuestra conclusión es que las reacciones de la enzima con diferentes compuestos proporcionan la energía libre para los cambios conformacionales, "dice Maglia.
Es más, El cambio conformacional también cambió la afinidad de las enzimas. Esto tiene sentido, ya que la enzima necesita unir dos sustratos y, después de completar la reacción, debe liberar ambos. "El sustrato y el producto son moléculas muy similares, por lo que la enzima necesita cambiar su afinidad para una liberación eficiente ".
Dos estados
Basado en estos estudios, Maglia puede ver cómo la enzima cambia entre dos estados:después de unir el sustrato, NADPH impulsa la reacción, que luego cambia la conformación de la enzima y por lo tanto su afinidad. Después, la unión de un nuevo sustrato lo devuelve al primer estado. "Esto explica dos de los cuatro confórmeros que observamos; todavía no podemos dar sentido a los otros dos, "Dice Maglia. Es imposible derivar información estructural de las mediciones.
Sin embargo, el estudio muestra el poder de la tecnología de nanoporos para determinar los cambios estructurales de las enzimas. "También sabemos ahora que esta enzima tiene cuatro estados fundamentales diferentes y debe cambiar entre ellos para funcionar". Esto agrega un desafío al diseño de enzimas:esto no solo debería producir un centro reactivo, pero también debe permitir los cambios conformacionales necesarios. Maglia:"Esto puede explicar por qué las enzimas diseñadas artificialmente a menudo no funcionan tan eficientemente como las enzimas naturales". Finalmente, el estudio también permitirá a los científicos identificar nuevos fármacos inhibidores que se unan más estrechamente al DHFR que el metotrexato.