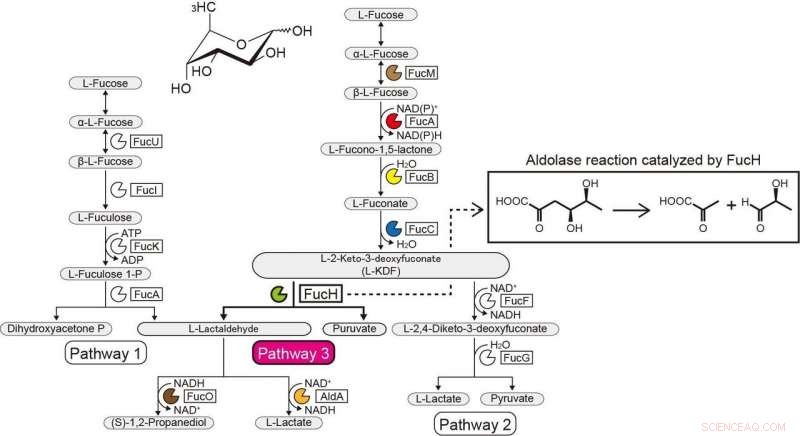
Vías metabólicas de la L-fucosa. Crédito:Universidad de Ehime
El contexto genético en los genomas bacterianos y la detección de sustratos potenciales pueden ayudar a identificar las funciones bioquímicas de las enzimas bacterianas. El Gram-negativo, La bacteria estrictamente anaeróbica Veillonella ratti posee un grupo de genes que parece estar relacionado con el metabolismo de la L-fucosa y contiene una supuesta proteína dihidrodipicolinato sintasa DHDPS / NAL (FucH). Aquí, El cribado de una biblioteca de ácidos 2-ceto-3-desoxiazúcares con esta proteína y la caracterización bioquímica de genes vecinos reveló que este grupo de genes codifica enzimas en una ruta de L-fucosa no fosforilante de "Ruta I" previamente desconocida.
Estudios previos de otras aldolasas en la superfamilia de proteínas DHDPS / NAL utilizaron solo un número limitado de compuestos, y el enfoque informado aquí permitió elucidar las especificidades del sustrato y las selectividades estereoquímicas de estas aldolasas y la comparación de ellas con las de FucH. Según la reacción de escisión aldólica, las aldolasas eran específicas para los grupos estereoespecíficos (R) y (S) en la posición C4 del ácido 2-ceto-3-desoxiazúcar, pero no tenía especificidad estructural o preferencia por los grupos metilo en las posiciones C5 y C6, respectivamente.
Esta categorización correspondía a la selectividad facial (Re) o (Si) de la enamina de piruvato en el aldehído carbonilo (glicer) en la reacción de condensación de aldol. Estas propiedades se determinan comúnmente por si un residuo de serina o treonina se coloca en la posición equivalente cerca del sitio (s) activo (s), y mutagénesis dirigida al sitio marcadamente modificada preferencia por C4-OH y la formación selectiva de un diastereoisómero. Proponemos que la especificidad de sustrato de las aldolasas del ácido 2-ceto-3-desoxiazúcar se adquirió de manera convergente durante la evolución e informamos del descubrimiento de otra L-2-ceto-3-desoxifuconato aldolasa involucrada en la misma vía de L-fucosa no fosforilante en Campylobacter jejuni .
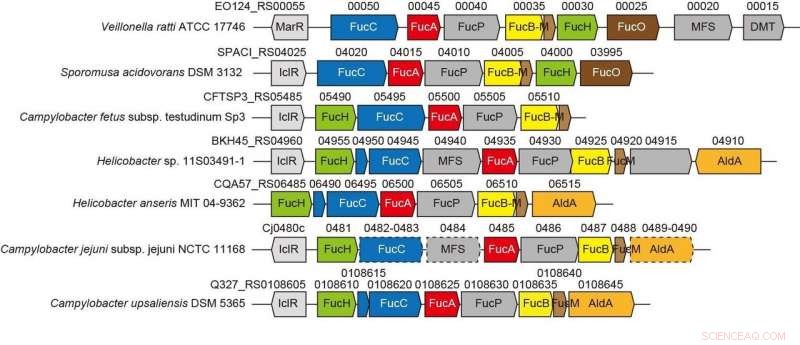
Agrupaciones de genes relacionados con la nueva vía de L-fucosa no fosforilativa de bacterias anaerobias y patógenas. Crédito:Universidad de Ehime