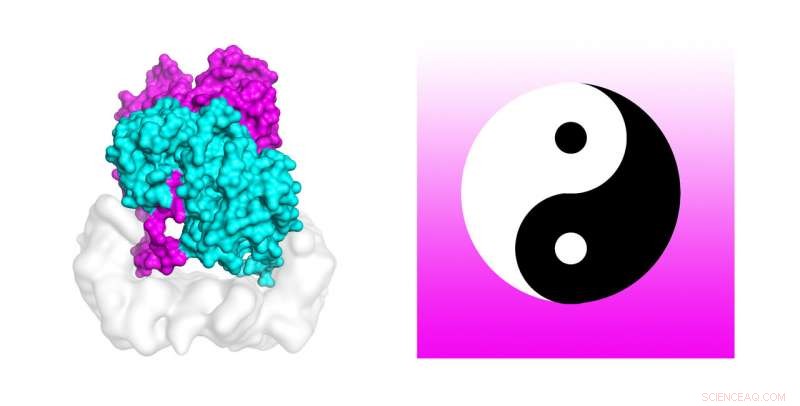
Los científicos están utilizando poderosas supercomputadoras para descubrir el mecanismo que activa las mutaciones celulares que se encuentran en aproximadamente el 50 por ciento de los melanomas. Las simulaciones de dinámica molecular en la supercomputadora Stampede2 de TACC probaron la estabilidad de la estructura del complejo B-Raf:14-3-3, que cuando muta está relacionado con el cáncer de piel. Los autores del estudio comparan el dímero B-Raf con el símbolo circular chino yin-yang de opuestos interconectados unidos en la cola. Crédito:Karandur et al., TACC
Comienza pequeño solo una mancha en la piel. Los lunares más comunes permanecen así:grupos inofensivos de células de la piel llamados melanocitos, que nos dan pigmento. En casos raros, lo que comienza como un lunar puede convertirse en melanoma, el tipo más grave de cáncer de piel humana porque puede diseminarse por todo el cuerpo.
Los científicos están utilizando poderosas supercomputadoras para descubrir el mecanismo que activa las mutaciones celulares que se encuentran en aproximadamente el 50 por ciento de los melanomas. Los científicos dicen que tienen la esperanza de que su estudio pueda ayudar a comprender mejor el cáncer de piel y al diseño de mejores medicamentos.
En 2002, Los científicos encontraron un vínculo entre el cáncer de piel y las mutaciones de la quinasa B-Raf (fibrosarcoma acelerado rápidamente), una proteína que forma parte de la cadena de señales que comienza fuera de la célula y entra para dirigir el crecimiento celular. Esta vía de señal, llamada vía de la quinasa Ras / Raf / Mek / Erk, es importante para la investigación del cáncer, que busca comprender el crecimiento celular descontrolado. Según el estudio, aproximadamente el 50 por ciento de los melanomas tienen una única mutación específica en B-Raf, conocido como el residuo de valina 600 a glutamato (V600E).
B-Raf V600E se convirtió así en un importante objetivo farmacológico, y en los años siguientes se desarrollaron inhibidores específicos del mutante. Las drogas inhibieron al mutante, pero sucedió algo extraño. Paradójicamente, calmar al mutante tenía un lado negativo. Activó lo no mutado, proteína quinasas B-Raf de tipo salvaje, que de nuevo desencadenó el melanoma.
"Con este trasfondo, trabajamos en el estudio de la estructura de esta importante proteína, B-Raf, "dijo Yasushi Kondo, investigador postdoctoral en el Laboratorio John Kuriyan de UC Berkeley. Kondo es coautor de un estudio de octubre de 2019 en la revista Ciencias que determinó la estructura del complejo de proteínas que componen B-Raf y también encontró cómo ocurre la activación paradójica de B-Raf.
"Nuestro objetivo era estudiar el estado más nativo de la proteína para comprender cómo se regula en las células, porque la mayoría de los estudios se han centrado en el dominio quinasa aislado y cómo los fármacos se unen al dominio quinasa ", dijo Kondo.
La proteína B-Raf de longitud completa está formada por varios dominios unidos por regiones desordenadas, algo demasiado difícil de manejar para que los científicos aún lo imaginen. La técnica de Kondo consistía en utilizar la química inteína para hacer fragmentos más pequeños, luego cóselos para obtener la estructura completa.
"Como resultado, obtuvimos una forma activa del dímero B-Raf de longitud completa llamado B-Raf co-purificado con el dímero 14-3-3, una proteína de andamiaje unida a la cola C-terminal de B-Raf fosforilada, "Dijo Kondo.
El grupo de Kondo utilizó microscopía crioelectrónica (crio-EM) para determinar la estructura del complejo B-Raf 14-3-3, básicamente congelar criogénicamente el complejo proteico, que lo mantuvo en un estado químicamente activo, entorno casi natural. A continuación, lo iluminaron con haces de electrones para obtener miles de 'fotogramas congelados'. Examinaron el ruido de fondo y reconstruyeron mapas de densidad tridimensionales que mostraban detalles previamente desconocidos en la forma de la molécula. Y para las proteínas, la forma sigue la funcion.
Kondo explicó que la estructura reveló una organización asimétrica del complejo, formado por dos conjuntos de dímeros simétricos internamente, o pares de moléculas unidas. "Proponemos que esta disposición inesperada permite la activación asimétrica del dímero B-Raf, que es un mecanismo que proporciona una explicación del origen de la activación paradójica de B-Raf por inhibidores de moléculas pequeñas, "Dijo Kondo.

La supercomputadora Stampede2 en el Texas Advanced Computing Center es un recurso asignado del Extreme Science and Engineering Discovery Environment (XSEDE) financiado por la National Science Foundation (NSF). Crédito:TACC
El análisis detallado de la estructura del complejo asimétrico B-Raf 14-3-3 mostró otra característica estructural inesperada, descrito como el segmento distal de la cola, DTS para abreviar, de una molécula de B-Raf. Kondo dijo que la cola de uno está ligada al sitio activo del otro, bloqueando su actividad compitiendo con la unión de ATP. La molécula de B-Raf bloqueada se estabiliza en la conformación activa. "Interpretamos esta estructura que esta molécula de B-Raf bloqueada funciona como un activador y estabiliza el otro receptor de B-Raf a través de la interfaz del dímero, "Dijo Kondo.
Suficientemente curioso, los autores comparan el dímero B-Raf con el símbolo circular chino yin-yang de opuestos interconectados unidos en la cola. "Al mirar al sujeto, está muy claro que uno no es capaz de fosforilar la molécula corriente abajo, que es necesario para el crecimiento celular. La otra molécula es claramente la que hace el trabajo. En este conjunto de dos moléculas, vemos claramente que uno está haciendo el trabajo de apoyo, y el otro está haciendo el trabajo real. Realmente parece Yin y Yang en este complejo B-Raf 14-3-3 que resolvimos, "Dijo Kondo.
Aspecto, aunque, puede ser engañoso. Los científicos usaron simulaciones por computadora para ayudar a verificar que realmente estaban en algo. "Realizamos simulaciones de dinámica molecular de este complejo del dímero B-Raf unido a un dímero 14-3-3 para probar la estabilidad de la conformación asimétrica, "dijo el coautor del estudio, Deepti Karandur, también investigador postdoctoral en el John Kuriyan Lab de UC Berkeley; también es becaria postdoctoral en el Instituto Médico Howard Hughes. "No sabíamos por qué la conformación era asimétrica, o qué papel desempeñó en el mantenimiento del estado activo de la enzima, "Dijo Karandur.
Comenzaron las simulaciones usando la estructura que Kondo había resuelto por cryo-EM, con el segmento DTS que va de una quinasa al sitio activo de la otra. Luego, ejecutaron un segundo conjunto de simulaciones con el segmento DTS eliminado.
"Lo que encontramos fue que en el sistema sin el segmento distal de la cola, todo el complejo no es estable, "Karandur explicó." Los dominios de quinasa se mueven con respecto al andamio, el dímero 14-3-3. En una de nuestras simulaciones, el estado dímero del propio B-Raf, que los experimentos han demostrado es necesario para mantener el estado activo de esta quinasa, se vino abajo indicando que este segmento distal de la cola, DTS, Es necesario realmente mantener este complejo en esta conformación asimétrica, que a su vez es necesario para mantener el dímero de quinasa en el estado activo estable del dímero asimétrico ".
Uno de los principales resultados del estudio fue encontrar el mecanismo de acción que activa el complejo quinasa B-Raf de dos quinasas B-Raf y dos proteínas de andamiaje 14-3-3, donde en B-Raf quinasa es el activador, y el otro es el receptor.
"La cola de la molécula receptora está dentro del sitio activo del activador, por lo que el activador no puede funcionar como enzima, "Dijo Kondo." En cambio, la molécula activadora estabiliza la conformación activa de la molécula receptora. La proteína de andamio 14-3-3 facilita esta disposición, de modo que la inserción de la cola solo le ocurre a una molécula de quinasa. Suponemos que cuando no hay unión 14-3-3, ambas quinasas pueden bloquearse mediante la inserción del DTS, pero esto necesita ser probado ".
Los desafíos computacionales del estudio involucraron simulaciones de dinámica molecular que modelaron la proteína a nivel atómico, determinar las fuerzas de cada átomo sobre cada otro átomo para un sistema de aproximadamente 200, 000 átomos en pasos de tiempo de dos femtosegundos.
"Para sistemas pequeños, podemos ver lo que está sucediendo relativamente rápido, pero para sistemas grandes como estos, especialmente grandes sistemas biomoleculares, estos cambios ocurren en escalas de tiempo de nanosegundos, escalas de tiempo de microsegundos, o incluso escalas de tiempo de milisegundos, "Dijo Karandur.
Karandur y sus colegas recurrieron a XSEDE, el entorno de descubrimiento de ciencias extremas e ingeniería financiado por la NSF, para el tiempo de asignación en la supercomputadora Stampede2 en el Centro de Computación Avanzada de Texas (TACC) para hacer las simulaciones, así como el sistema Bridges en el Pittsburgh Supercomputer Center para investigar otras proteínas en la vía. Nodos del procesador Skylake de Stampede2, en red con Intel Omnipath, hizo un trabajo rápido de las simulaciones de dinámica molecular NAMD optimizadas para supercomputadoras.
"Stampede2 funciona muy muy rapido, y es muy eficiente. Generamos un total de aproximadamente 1,5 microsegundos de trayectorias para nuestros sistemas en aproximadamente cuatro a seis semanas. Mientras que, si lo ejecutáramos en nuestro propio clúster interno, nos habría llevado meses o más, "Dijo Karandur.
Acerca de XSEDE, Karandur comentó:"Creo que es un recurso asombroso. He estado ejecutando simulaciones desde que era un estudiante de posgrado. XSEDE nos permitió acceder a escalas de tiempo que son biológicamente relevantes. Todo lo que sucede en una celda, ocurre en escalas de tiempo de microsegundos, a escalas de tiempo de milisegundos, a más. Cuando estaba empezando no pudimos ejecutar esta simulación en ningún sistema en ningún lugar. Quiero decir, hubieran tardado cinco años, o más. Poder hacerlo en semanas y decir:okey, sabemos entender por qué esto es importante para que ahora podamos comenzar a obtener una comprensión real de cómo ocurre la biología, es simplemente asombroso, "Dijo Karandur.
Y queda mucho por descubrir sobre B-Raf. Es solo un eslabón en la cadena de señales que gobierna el crecimiento celular y el cáncer.
"La estructura que se resolvió en este documento es parte de un gran sistema multidominio, "Karandur explicó." No sabemos cómo es esta proteína completa. No lo vemos en la estructura. No sabemos cómo es su dinámica, y cómo todas estas otras partes de la proteína juegan un papel en el mantenimiento del estado activo, o convertirlo del estado inactivo al estado activo ".
Ella avanzó en eso a medida que el sistema se hace más grande, los cambios estructurales pertinentes ocurren en escalas de tiempo más largas, y se necesitan supercomputadoras más grandes para manejar la complejidad, como la supercomputadora Frontera, financiada por la NSF, también en TACC.
"Frontera está llegando allí. Estamos muy entusiasmados con esto. Estamos en el proceso de obtener una asignación en Frontera, "Dijo Karandur.
Para los no científicos, esta investigación fundamental podría brindar información que conduzca a mejores medicamentos para el cáncer de piel.
"La activación paradójica de la quinasa Raf por estos inhibidores específicos de B-Raf convierte las células normales en tumores durante el tratamiento del cáncer de piel, ", Dijo Kondo. Comprender el mecanismo de este fenómeno nos permitirá diseñar mejores fármacos. Con suerte, nuestro estudio puede contribuir a la comprensión de este paso. Además, encontramos mutaciones en este enlace entre el dominio quinasa y el elemento de unión 14-3-3 de la molécula B-Raf, que nunca se mostró antes. Esta mutación reduce la actividad de B-Raf en las células. También indica que esta parte del dominio quinasa puede ser un punto objetivo para desarrollar nuevos tipos de inhibidores de B-Raf ".
Karandur dijo:"Hay muchas dinámicas sucediendo en la célula. Estamos, en gran parte debido a XSEDE, solo comenzando a ser capaz de ver cosas así. Avanzando, la única forma en que podemos seguir viendo las cosas es utilizando muy, supercomputadoras muy grandes, porque los cálculos requieren mucha potencia computacional. Es realmente emocionante poder ver cómo suceden estas cosas y decir:así es como cambian las cosas a nivel atómico; aquí están estas interacciones entre estos dos átomos que se forman o se rompen, y eso se traduce en este gran cambio a nivel global en la estructura general de la proteína, y cómo interactúa con otras proteínas, u otras moléculas en la célula. Estamos muy entusiasmados con el futuro ".
El estudio, "La estructura crio-EM de un complejo dimérico B-Raf:14-3-3 revela asimetría en los sitios activos de las quinasas B-Raf, "fue publicado el 4 de octubre de 2019 en la revista Ciencias .