Crédito:Universidad McGill
Los investigadores de la Facultad de Medicina de la Universidad McGill han logrado importantes avances en la comprensión del funcionamiento de las enzimas que desempeñan un papel integral en la producción de antibióticos y otras terapias. Sus hallazgos se publican en Ciencias .
"Muchos de los medicamentos de los que dependemos hoy son productos naturales, hecho por la flora de la Tierra, "explica el Dr. Martin Schmeing, Profesor asociado en el Departamento de Bioquímica de McGill y autor principal del estudio. "Esto incluye compuestos producidos en microbios por enzimas masivas llamadas péptido sintetasas no ribosomales, o NRPS. Los NRPS sintetizan todo tipo de antibióticos, que pueden matar hongos y bacterias peligrosos, así como compuestos para ayudarnos a combatir infecciones virales y cánceres. Por ejemplo, estos compuestos incluyen viomicina, un antibiótico utilizado para el tratamiento de la tuberculosis multirresistente; ciclosporina, que ha sido ampliamente utilizado como inmunosupresor en trasplantes de órganos; y el conocido antibiótico penicilina ".
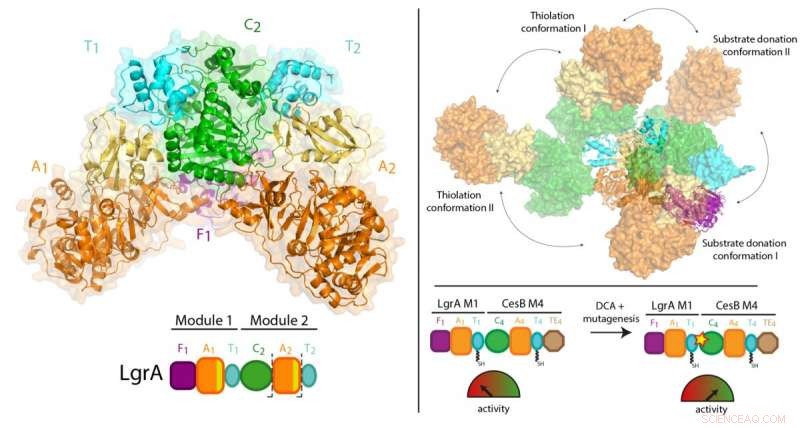
Para sintetizar estos fármacos, Los NRPS operan de manera similar a una línea de ensamblaje de fábrica, que consta de una serie de estaciones de trabajo. Cada estación, llamado "módulo, "tiene flujos de trabajo de varios pasos y partes móviles que le permiten agregar un componente básico al fármaco en crecimiento.
Comprender el funcionamiento interno de la línea de montaje
El trabajo anterior del Dr. Schmeing y otros ha llevado a una sólida comprensión de cómo funciona un módulo. Ahora, utilizando una técnica llamada cristalografía de rayos X en la fuente de luz canadiense en Saskatchewan, y la fuente de fotones avanzada en Illinois, el equipo pudo tomar fotografías en 3D de ultra alta resolución de los NRPS.
Por primera vez, pudieron hacer observaciones de alta calidad sobre cómo un módulo individual se relaciona con la línea de ensamblaje más grande, visualizando una porción de dos módulos de los NRPS que hace que el antibiótico sea gramicidina lineal (que se encuentra en los tratamientos con Polysporin). El estudio encontró una sorprendente falta de sincronización entre los módulos en todos los puntos excepto cuando deben coordinarse para pasar el intermedio de una estación de trabajo a la siguiente. Adicionalmente, descubrieron que los módulos no se alinean en línea recta ni de otra manera organizada, pero en cambio puede alinearse en muchas posiciones relativas diferentes. "Este nivel de flexibilidad masiva no se esperaba, "señala el Dr. Schmeing, quien también es Director del Centro de Biología Estructural de McGill. "Las enzimas están realizando gimnasia".
Debido a que las proteínas están atrapadas en un cristal, se tuvo cuidado de confirmar que los resultados fueran representativos de lo que sucede en la vida real. El Dr. Schmeing trabajó con su colega, Dra. Alba Guarné, Profesor del Departamento de Bioquímica de McGill, utilizar datos complementarios de la solución, recopilados en la fuente de luz avanzada en Berkeley para validar las observaciones. "La comunidad de biología estructural es muy fuerte en McGill. Trabajamos juntos para ayudarnos unos a otros en colaboraciones, para obtener el equipo biofísico necesario para experimentos de vanguardia, y capacitar a nuestros estudiantes ", dice el Dr. Schmeing, señalando que los experimentales en el papel, Janice Reimer, Max Eivaskhani e Ingrid Harb, son todos talentosos estudiantes graduados de McGill. "El medio ambiente y los colegas del Centro McGill de Biología Estructural son importantes para el éxito continuo de nuestros laboratorios".
Implicaciones futuras para el diseño terapéutico
Los resultados podrían tener implicaciones para la producción de nuevos antibióticos y terapias a largo plazo. Desde que fueron descubiertos por primera vez, Los científicos han estado entusiasmados con la posibilidad de bioingeniería de NRPS mediante la mezcla y combinación de estaciones de trabajo para producir compuestos de diseño. "Nuestro estudio muestra que debería ser posible combinar y combinar estos módulos, pero que los NRPS de bioingeniería deben modificarse en los puntos involucrados en el paso del compuesto de un módulo al siguiente para que funcionen bien, "explica el Dr. Schmeing." Esto es algo que hicimos en equipo con Martin Weigt de la Sorbona como prueba de principio en el documento, pero que deberá optimizarse para la producción de terapias de diseño ".
"Las estructuras de un péptido sintetasa dimodular no ribosómico revelan flexibilidad conformacional, "por Reimer, J. M., Eivaskhani, METRO, Harb, I., Guarne, A, Peso METRO., Schmeing, T. M. fue publicado en la revista Ciencias .