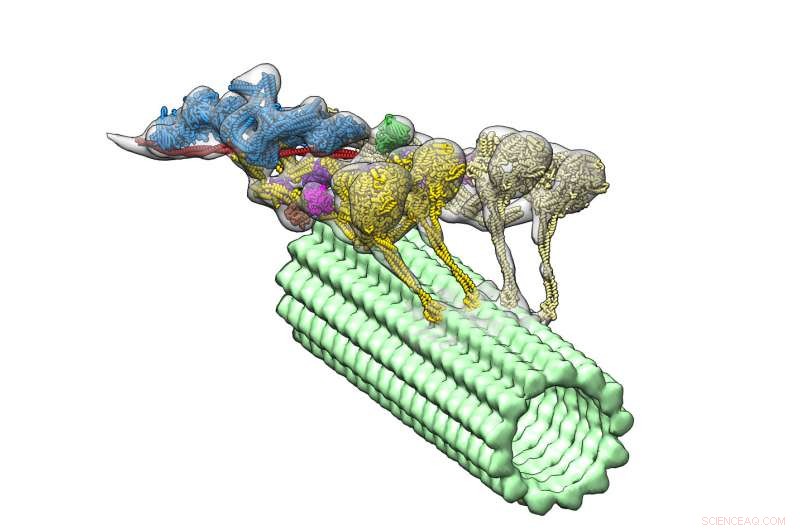
El complejo dineína-dinactina (multicolor) se desplaza por un microtúbulo (verde). Los cuatro dominios motores se muestran en amarillo. Dynactin (azul) proporciona el andamio para mantener juntas las dos dineínas. Crédito:Danielle Grotjohn, Laboratorio de Lander
En la carretera celular las proteínas motoras llamadas dineínas gobiernan el camino. Las dineínas "caminan" a lo largo de estructuras llamadas microtúbulos para entregar carga celular, como moléculas de señalización y orgánulos, a diferentes partes de una celda. Sin dineína en el trabajo las células no se pueden dividir y las personas pueden desarrollar enfermedades neurológicas.
Ahora un nuevo estudio, que aparece en la revista Naturaleza Biología Molecular y Estructural , proporciona la primera visualización tridimensional (3D) del complejo dineína-dinactina unido a los microtúbulos. Los líderes del estudio del Instituto de Investigación Scripps (TSRI) informan que una proteína llamada dinactina une dos dineínas, como un yugo que une a un par de caballos de tiro.
"Si quieres que un equipo de caballos se mueva en una dirección, necesitas alinearlos, "dice Gabriel C. Lander, Doctor, profesor asociado de TSRI y autor principal del estudio. "Eso es exactamente lo que le está haciendo la dinactina a las moléculas de dineína".
Comprender cómo se ensambla y organiza el complejo dineína-dinactina proporciona una base fundamental para explicar las causas subyacentes de varias enfermedades neurodegenerativas relacionadas con la dineína, como la atrofia muscular espinal (AME) y la enfermedad de Charcot-Marie-Tooth (CMT).
Los investigadores sabían que se requiere dinactina para que la dineína mueva la carga, pero lucharon por obtener una imagen completa de cómo funcionaban juntas las diferentes partes del complejo.
"Sabíamos que la dineína solo se activa cuando se une a un compañero llamado dinactina. El problema era que, históricamente, Fue difícil resolver esta estructura porque es muy flexible y dinámica, "explica Danielle Grotjahn, estudiante de posgrado de TSRI y co-primer autor del estudio. "Necesitábamos visualizar estos complejos dineína-dinactina para comprender fundamentalmente cómo funciona para transportar moléculas".
Para el nuevo estudio, Los investigadores utilizaron una técnica de imagen llamada tomografía crioelectrónica, que es similar a adquirir una tomografía computarizada de una proteína, para producir una reconstrucción 3D, o tomografía. Para aumentar la resolución y claridad de estos tomogramas, Los investigadores utilizaron algoritmos computacionales avanzados para promediar juntos muchos complejos de proteínas individuales.
En este caso, sin embargo, los métodos de procesamiento actuales no pudieron producir una clara, Estructura 3D interpretable del complejo dineína-dinactina extremadamente flexible.
Grotjahn sabía que la información necesaria estaba oculta en los tomogramas, así que desarrolló una nueva estrategia para identificar componentes específicos del complejo dineína-dinactina. Este enfoque ayudó a guiar el software de procesamiento de imágenes para reconstruir todo el complejo motor unido a los microtúbulos.
"Danielle estaba dando el primer gran paso para los algoritmos computacionales, "dice Lander.
Con su nuevo, estructura detallada, los investigadores notaron una característica sorprendente:el complejo tiene dos moléculas de dineína donde esperaban ver solo una. Esto significa que debido a que cada dineína tiene dos dominios motores, el complejo dineína-dinactina tiene cuatro dominios motores en total.
"Este descubrimiento fue totalmente inesperado, y cambiará la forma en que este complejo motor se representa en los libros de texto de biología celular y bioquímica, "dice Saikat Chowdhury, Doctor, investigador asociado de TSRI y coautor del estudio.
"Ha habido años de experimentos biofísicos y bioquímicos, y siempre se asumió que solo había una molécula de dineína, ", Agrega Lander.
Los investigadores también pudieron ver dónde encajaba la dinactina. Descubrieron que la molécula proporciona un andamio estable, uniendo el equipo de dominios motores y activando su capacidad para moverse a lo largo de los microtúbulos. Este descubrimiento ayuda a explicar cómo la dineína puede transportar grandes cargas, como orgánulos que son mucho más grandes que ellos mismos, a largas distancias en un entorno celular abarrotado.
El enfoque de procesamiento de imágenes utilizado en este estudio tiene el potencial de ser extremadamente útil para resolver las estructuras de otros grandes, proteínas flexibles.
"Ahora podemos dejar atrás los modelos de dibujos animados y visualizar los detalles finos de muchos complejos macromoleculares dinámicos, ", dice Grotjahn." A medida que aprendemos más sobre la organización y la arquitectura 3D de estas máquinas moleculares, estaremos mejor equipados para comprender cómo funcionan mal en caso de enfermedad ".
Autores adicionales del estudio, "La tomografía crioelectrónica revela que la dinactina recluta un equipo de dineínas para la motilidad progresiva, "fueron Yiru Xu del Instituto de Investigación Scripps; Richard J. McKenney de la Universidad de California, Davis; y Trina A. Schroer de la Universidad Johns Hopkins.