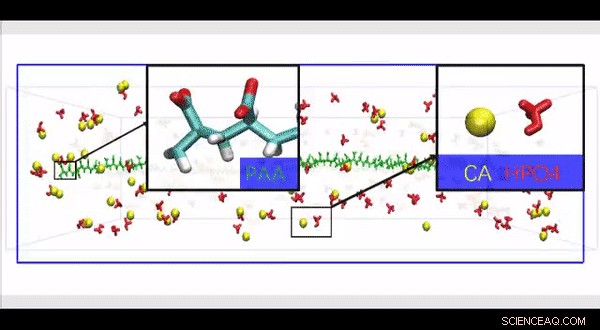
Simulación completa de dinámica molecular atomística de una estructura de colágeno HPAA de alta resolución construida para investigar el efecto de la presencia de grandes moléculas de polielectrolito a lo largo de la superficie de la fibrilla de colágeno sobre el movimiento y la infiltración de iones en un modelo biomimético. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
Los organismos vivos forman minerales biológicos durante la biomineralización, donde los elementos inorgánicos pueden depositarse selectivamente en macromoléculas orgánicas específicas bajo un control preciso. El proceso se puede dividir en biocalcificación o biosilicificación basada en el componente inorgánico, con colágeno utilizado como plantilla universal. Durante la mineralización intrafibrilar, Las matrices de colágeno destinadas a la mineralización en vertebrados contienen proteínas de la matriz unidas a la superficie. Comprender los complejos mecanismos de la mineralización intrafibrilar para formar tejido colágeno duro, como el hueso y la dentina, es de gran interés en biomecánica. con décadas de estudios realizados para imitar o modelar el proceso en el laboratorio. En un estudio reciente, ahora publicado en Avances de la ciencia , Q. Song y colaboradores en los Departamentos interdisciplinarios de Biología, Física Aplicada, Ciencia e Ingeniería de los Materiales, Ciencias Biomédicas y Medicina Dental, en China, Estados Unidos e Italia, han desarrollado un modelo biomecánico para examinar las interacciones colágeno-ligando que contribuyen a la mineralización intrafibrilar.
En el estudio, usaron carga negativa, ácido policarboxílico de alto peso molecular, entrecruzado con colágeno reconstituido, para crear el modelo biomimético. Realizaron microscopía electrónica criogénica y simulaciones de dinámica molecular, para mostrar que los agregados en forma de cadena se formaron después de la reticulación con el colágeno, a lo largo de la superficie fibrilar para implementar la mineralización fibrilar. Observaron que los cargados negativamente, Los andamios mineralizados les permitieron lograr una mayor calidad con mejores propiedades biomecánicas, en comparación con la mineralización en andamios no modificados. El trabajo sobre la interacción colágeno-ligando proporcionó a los científicos información sobre el origen de los tejidos mineralizados heterogéneamente y también aclaró las posibles causas de la calcificación ectópica (biomineralización inapropiada) en tejidos corporales no mineralizados.
Los biominerales que se encuentran en la naturaleza contienen inherentemente calcio para formar fosfato cálcico (CaP) y fosfato octacálcico como ejemplos. Los biominerales que contienen CaP constituyen específicamente tejidos conectivos duros vertebrales, mientras que el carbonato de calcio forma el esqueleto invertebral. Las fibrillas de colágeno se pueden usar como plantillas de mineralización debido a los canales a nanoescala en sus estructuras fibrilares para formar híbridos de nanoingeniería con fuerza y resiliencia combinadas. Sin embargo, el proceso no se puede lograr simplemente sumergiendo matrices de colágeno en una solución sobresaturada de iones minerales, en su lugar, requiere el uso de inhibidores de nucleación para estabilizar los complejos de asociación de iones y prevenir su cristalización fuera de las fibrillas. Como resultado, En la ultima década, Los científicos han propuesto diferentes modelos in vitro para comprender los mecanismos de mineralización intrafibrilar. En los modelos de estudio anteriores, Los inhibidores de la nucleación de cristales se incluyeron en el medio de mineralización y no se unieron a las fibrillas de colágeno. partiendo del escenario típico que ocurría en los sistemas biológicos. En el presente modelo de estudio, Song y col. por lo tanto, permitió que los inhibidores se unieran a las fibrillas de colágeno para una biomimetización adecuada.
Caracterización de PAA-colágeno. (A) Espectros infrarrojos de esponjas de PAA-colágeno. Los espectros se normalizaron a lo largo del pico de amida de colágeno A (~ 3300 cm − 1, Estiramiento NH junto con enlace de hidrógeno) En comparación con el espectro del colágeno desnudo, los espectros de las esponjas de colágeno unido a HPAA (colágeno HPAA) y colágeno unido a LPAA (colágeno LPAA) muestran aumentos en la amida B, I, II, y III picos. (B) Superficie sólida ζ potencial de colágeno HPAA, LPAA-colágeno, y colágeno desnudo. La reticulación de PAA a la molécula de colágeno resultó en potenciales ζ significativamente menores de -17,17 ± 1,98 mV para el colágeno HPAA, −15,19 ± 1,22 mV para colágeno LPAA, y -3,04 ± 0,37 mV para colágeno desnudo. (C y D) Comparación de grupos carboxilo (C) y amina (D) entre PAA-colágeno y colágeno desnudo. Después de la modificación aniónica, las cantidades de grupo carboxilo (en mM / g de colágeno) en el colágeno HPAA (1,907 ± 0,084) y el colágeno LPAA (1,807 ± 0,035) fueron significativamente mayores que las del colágeno desnudo (0,460 ± 0,017). Crédito:Science Advances, doi:10.1126 / sciadv.aav9075. 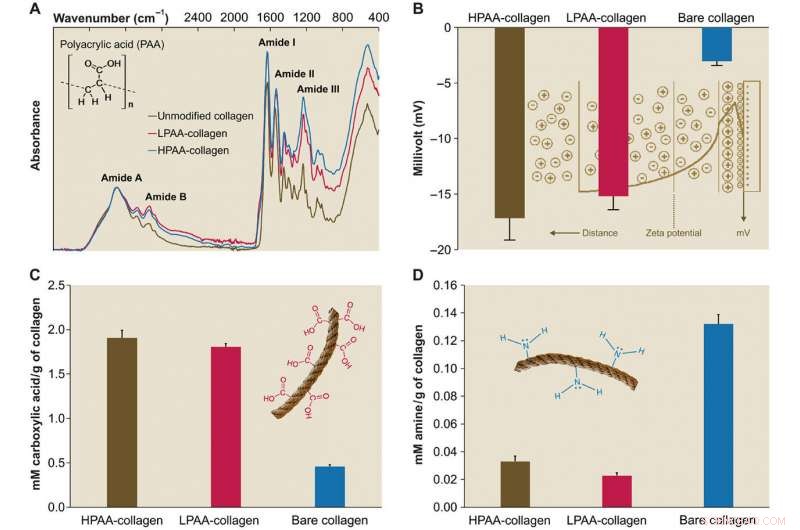
Dado que las proteínas fisiológicas no colágenas son difíciles de extraer y funcionalmente complejas para su uso en estudios de mineralización biomimética, Song y col. utilizaron polielectrolitos aniónicos como inhibidores de nucleación en su modelo de mineralización intrafibrilar. Los polielectrolitos aniónicos pueden imitar la conformación proteica altamente aniónica e intrínsecamente desordenada que se encuentra en las proteínas no colágenas. En el modelo propuesto, los inhibidores de nucleación de polielectrolitos se unieron al colágeno reconstituido libre de proteínas de la matriz como modelos de mineralización intrafibrilar. Song y col. Primero simuló la dinámica molecular para mostrar que un polielectrolito como el ácido poliacrílico (PAA) podría reservar complejos de iones de fosfato de hidrógeno y calcio en agregados en forma de cadena a lo largo de la superficie de la macromolécula tras su introducción en un medio de mineralización de CaP sobresaturado.
Basado en la dinámica molecular simulada, Song y col. desarrolló una hipótesis de prueba de que un inhibidor de nucleación unido a la superficie de las fibrillas de colágeno podría estabilizar los precursores de mineralización de CaP cerca de las fibrillas, para una mineralización intrafibrilar eficiente. Para probar la hipótesis, en su lugar, utilizaron controles con una versión no unida del mismo polielectrolito utilizado para estabilizar los precursores de CaP incluidos en el medio de mineralización.

Simulando la fase tardía de la mineralización intrafibrilar del colágeno HPAA. Representación 3D de la fase tardía de la mineralización intrafibrilar de colágeno HPAA que muestra la acumulación de agregados de racimos de prenucleación (amarillo) a lo largo de la superficie de las fibrillas; Los minerales intrafibrilares se representan en naranja. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
Los científicos utilizaron ácido poliacrílico de alto peso molecular - PAA (HPAA) para simular la osteopontina y PAA de bajo peso molecular (LPAA) para simular la osteocalcina. Reticularon químicamente los electrolitos polianiónicos para reconstituir fibrillas o esponjas de colágeno de tipo I usando compuestos orgánicos y examinaron la constitución del polímero usando espectroscopía infrarroja por transformada de Fourier (FTIR). Song y col. utilizaron microscopía electrónica de transmisión (TEM) para observar fibrillas de colágeno unidas a PAA que se tiñeron de rojo y las registraron como agregados filamentosos densos en electrones en la superficie de las fibrillas. Luego utilizaron cromatografía líquida de alta resolución para examinar las características de unión / liberación de esponjas de PAA-colágeno.
Simulando la dinámica molecular de la biomineralización
Para comprender las diferentes fases de la mineralización intrafibrilar del colágeno unido a HPAA (colágeno HPAA), los científicos crearon películas utilizando los datos de tomografía electrónica de las diversas fases de la biomineralización. Simularon la (1) fase inicial:para mostrar la acumulación de agregados de grupos de prenucleación alrededor de la fibrilla de colágeno no mineralizada, (2) fase media:para mostrar una mineralización intrafibrilar parcial y (3) fase tardía:para mostrar una mineralización intrafibrilar intensa de las fibrillas de colágeno HPAA. Demostraron que el colágeno LPAA no indujo la mineralización intrafibrilar en comparación con el HPAA en el estudio, y por lo tanto no incluyó los polímeros en los experimentos posteriores.

Simulaciones de dinámica molecular. (A) Perfil de estructuras microfibrilares de colágeno desnudo con moléculas de agua dentro de los espacios intrafibrilares. Cintas azules, triples hélices de colágeno; puntos rojos, moléculas de agua. (B) Vista lateral de microfibrillas de colágeno desnudas. Las líneas azules describen la caja de simulación de 67 nm de largo. (C y D) Movimiento de Ca2 + (esferas amarillas), HPO42− (conjuntos rojos), y precursores de mineralización de CaP ensamblados (ensamblajes amarillo-rojo) a través de las microfibrillas de colágeno con la HPAA (cadena verde) unida a los aminoácidos LYS1099 de las moléculas de colágeno. (E) Arriba:simulación del movimiento de varios iones a través de las estructuras microfibrilares de colágeno HPAA en tiempos de simulación designados. Esferas azules, esferas moradas, esferas amarillas, asamblea roja, ensamblajes amarillo-rojo, y la estructura de la cadena verde representan iones de Na +, Iones Cl−, Iones Ca2 +, Iones HPO42−, Precursores de mineralización de CaP, y HPAA, respectivamente. Abajo:cambios dinámicos en el número de Ca2 + (línea negra), HPO42− (línea roja), Na + (línea verde), y Cl− (línea azul) en las regiones intrafibrilar y extrafibrilar a lo largo del límite del eje a en 0, 30, 50, y 70 ns. (F) Movimiento de Ca2 +, HPO42−, y precursores de mineralización de CaP ensamblados a través de las microfibrillas de colágeno desnudas con HPAA no unido en la región extrafibrilar (control). (G) Comparación de la distribución de varios iones dentro de la región intrafibrilar en los modelos de mineralización HPAA unido a colágeno y HPAA no unido. (H) Comparación de la desviación cuadrática media de las moléculas de colágeno en los modelos HPAA unido a colágeno y HPAA no unido. (I) Comparación del área de superficie accesible al solvente (SASA) de las moléculas de colágeno entre los dos modelos. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
Song y col. posteriormente, utilizó simulaciones de dinámica molecular del proceso de mineralización para comprender la relación estructura-función y validó la capacidad de la HPAA unida al colágeno para agregar precursores de mineralización de CaP. Para esto, utilizaron un modelo atomístico completo del complejo de fibrillas de colágeno-HPAA hidratado. En el modelo de unidad, ellos simularon Ca 2+ y HPO 4 2- iones y precursores de mineralización de CaP ensamblados para formar alrededor del HPAA unido al colágeno. El trabajo reveló la distribución de iones de sodio, cloruro, calcio y HPO 4 2- iones a lo largo del eje del límite del modelo unitario.
Examinando la ultraestructura
Para exámenes ultraestructurales del modelo biomimético, Song y col. utilizó nanoindentación para evaluar los módulos de Young de fibrillas de colágeno mineralizadas y no mineralizadas con microscopía de fuerza atómica (AFM). Los valores fueron similares a los reportados previamente para fibrillas mineralizadas y no mineralizadas, calculado usando nanoindentación. Los científicos utilizaron espectroscopía de difracción de rayos X para identificar la presencia de apatita en las esponjas mineralizadas. El estudio mostró que el colágeno HPAA mineralizado en solución de CaP durante siete días tenía un contenido mineral más alto que el colágeno desnudo. Cuando Song et al. calculó la relación apatita / colágeno en los perfiles espectroscópicos, las esponjas de colágeno HPAA indicaron niveles más altos de mineralización.
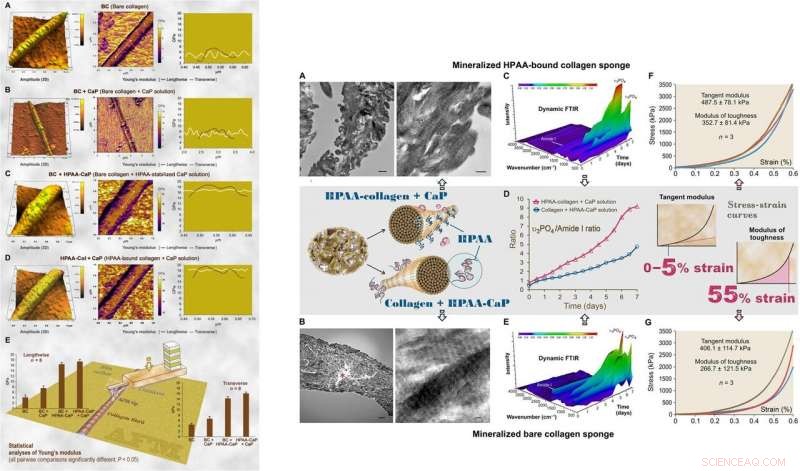
:IZQUIERDA:AFM de la topografía de la superficie 3D y mapeo del módulo de elasticidad (módulo de Young) de representativo secado al aire, colágeno desnudo mineralizado y fibrillas de colágeno HPAA. (A) Las fibrillas de colágeno desnudas (BC) tenían una distribución cercana a la normal del módulo de Young transversalmente a través de la fibrilla. (B) Colágeno desnudo mineralizado en solución de CaP sin inhibidor de nucleación (BC + CaP). (C) Colágeno desnudo mineralizado con solución HPAA-CaP (BC + HPAA-CaP). (D) HPAA-colágeno mineralizado con solución de CaP sin inhibidor de nucleación (HPAA-Col + CaP). (E) Análisis estadísticos del módulo de Young de fibrillas de colágeno en las direcciones longitudinal y transversal (n =8). DERECHA:Caracterización de esponjas de colágeno HPAA mineralizado y esponjas de colágeno desnudo. (A) TEM de esponjas de colágeno HPAA mineralizado. (B) TEM de esponjas de colágeno desnudas mineralizadas. (C) Reflexión total atenuada dinámica (ATR) - FTIR muestra mineralización progresiva de una esponja de colágeno HPAA a intervalos de 12 horas durante un período de 7 días. (D) Cambios en la proporción de apatita υ3PO4 / amida de colágeno I de las esponjas de colágeno aniónico mineralizado y las esponjas de colágeno sin modificar. E) Dynamic ATR-FTIR muestra el progreso de la mineralización de una esponja de colágeno desnuda en solución HPAA-CaP. (F) Respuesta tensión-deformación de esponjas de colágeno HPAA mineralizado para determinar el módulo de tangente y el módulo de tenacidad (recuadro, fila del medio). (G) Respuesta estrés-deformación de las esponjas de colágeno desnudas mineralizadas. Crédito:Science Advances, doi:10.1126 / sciadv.aav9075.
El módulo de tenacidad, que normalmente indica la energía por unidad de volumen que un material puede absorber antes de romperse, también fue significativamente mayor para las esponjas de colágeno HPAA, lo que indica la resistencia a la fractura del material. Tales características explican la alta resiliencia de los tejidos biomineralizados a base de colágeno que imitan la microarquitectura ósea para combinar las propiedades óseas de tenacidad y resistencia en la ingeniería regenerativa. Song y col. atribuyó las propiedades observadas de cohesión / adhesión a la reticulación de HPAA, que permitió crear el compuesto de colágeno / mineral, similar a la osteopontina reticulada que se encuentra en la arquitectura ósea.
Aplicaciones de los nuevos constructos biocompatibles
Dado que la biocompatibilidad de los nuevos materiales es una característica importante en la ciencia de los materiales y la bioingeniería, Song y col. verificaron interacciones favorables de material celular en colágeno reticulado con HPAA utilizando la viabilidad y proliferación de células madre durante el cultivo de células de regeneración ósea en el laboratorio. Cuando los científicos realizaron ensayos de apoptosis y deshidrogenasa mitocondrial en células madre mesenquimales humanas, no observaron diferencias significativas entre el colágeno HPAA no mineralizado y las esponjas de colágeno desnudo. Debido a su compatibilidad con las células similares a los osteoblastos humanos, tales materiales se pueden utilizar como revestimientos biocompatibles para implantes quirúrgicos.
De este modo, Song y col. demostraron un modelo biomecánico de mejora de la mineralización intrafibrilar utilizando interacciones colágeno-ligando para comprender los mecanismos específicos del sitio. Este modelo de interacciones colágeno-ligando también puede arrojar luz sobre las posibles causas de la mineralización ectópica, que es de interés en la actualidad. En la perspectiva de Song et al., La mineralización intrafibrilar a través de interacciones colágeno-ligando puede infiltrar minerales de manera más consistente en matrices de colágeno a granel para aplicaciones en medicina regenerativa. Los resultados ayudarán a comprender las propiedades biomecánicas, mientras se reducen los defectos para aumentar las características biomiméticas de una matriz de colágeno mineralizado en la ingeniería de tejidos.
© 2019 Science X Network