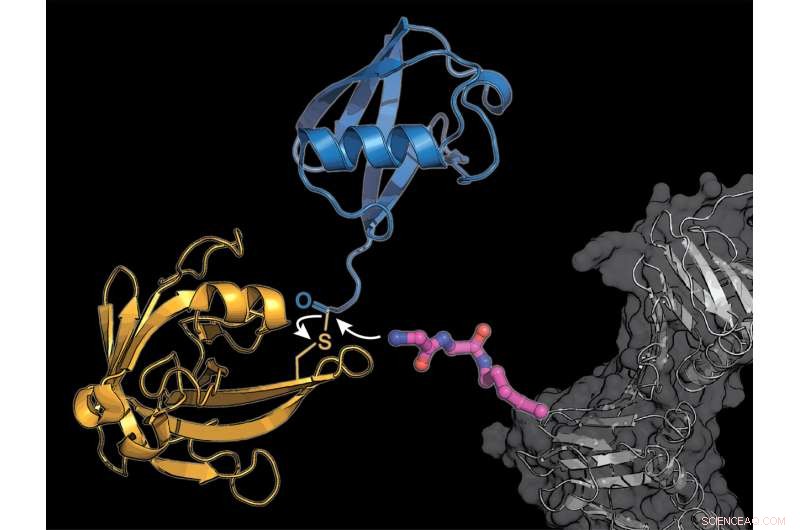
Los investigadores equiparon una proteína celular (gris) con un bloque de construcción de aminoácido lisina modificado (rosa), a la que la enzima bacteriana sortasa (amarilla) transmite una molécula de ubiquitina (azul). Crédito:K. Lang / TUM
Las células humanas tienen un sistema regulador sofisticado que consiste en marcar proteínas con la molécula pequeña de ubiquitina. En una primera un equipo de la Universidad Técnica de Múnich (TUM) ha logrado marcar proteínas con ubiquitina de manera selectiva en tubos de ensayo y en células vivas. El procedimiento abre la puerta para explorar el funcionamiento interno de este sistema regulador vital.
Plantas hongos los animales y los seres humanos expresan la proteína ubiquitina. Comprende una secuencia de 76 aminoácidos, convirtiéndola en una biomolécula relativamente pequeña. Pero su influencia es de gran alcance:el tipo, la posición y el número de moléculas de ubiquitina unidas a proteínas determinan su estabilidad, función, y ubicación dentro de la celda.
"Prácticamente todos los procesos de la célula se ven afectados directa o indirectamente por la ubiquitina. Es por eso que el mal funcionamiento de este mecanismo de etiquetado está asociado con el desarrollo y la progresión del cáncer y muchas otras enfermedades graves". "explica Kathrin Lang, Catedrático de Bioquímica Sintética en la Universidad Técnica de Munich.
El descubrimiento del importante papel que juega este sistema regulador celular en la degradación controlada de proteínas fue reconocido con el Premio Nobel de Química 2004. Pero, en muchos casos, los detalles de cómo las modificaciones de ubiquitina afectan la función de las células siguen sin estar claros. El equipo de Kathrin Lang ha desarrollado ahora un método para unir etiquetas de ubiquitina a proteínas específicas, una clave para explorar el sistema.
Una enzima bacteriana crea nuevos compuestos.
El equipo de Lang utiliza dos trucos para sortear el complicado sistema natural:incorporan un nuevo aminoácido modificado, en el que la enzima sortasa derivada de bacterias puede unir ubiquitina o una molécula similar a la ubiquitina.

El primer autor Maximilian Fottner y la profesora Kathrin Lang en su laboratorio. Crédito:Andreas Battenberg / TUM
"El mayor desafío fue alinear los diversos pasos, la incorporación del aminoácido no natural en una proteína objetivo y la transferencia de ubiquitina por la enzima sortasa, de tal manera que funcionen no solo en el tubo de ensayo sino también en la vida. células, "recuerda Maximilian Fottner, el autor principal del estudio.
Mientras tanto, los investigadores de la Universidad Técnica de Munich han optimizado y patentado su nuevo método para muchas proteínas celulares diferentes. “Ya hemos iniciado colaboraciones con médicos y biólogos celulares que ahora quieren trabajar con nosotros para estudiar los efectos de los marcadores de ubiquitina en el desarrollo de cáncer y enfermedades neurodegenerativas como el Parkinson a nivel molecular, "dice el profesor Lang.