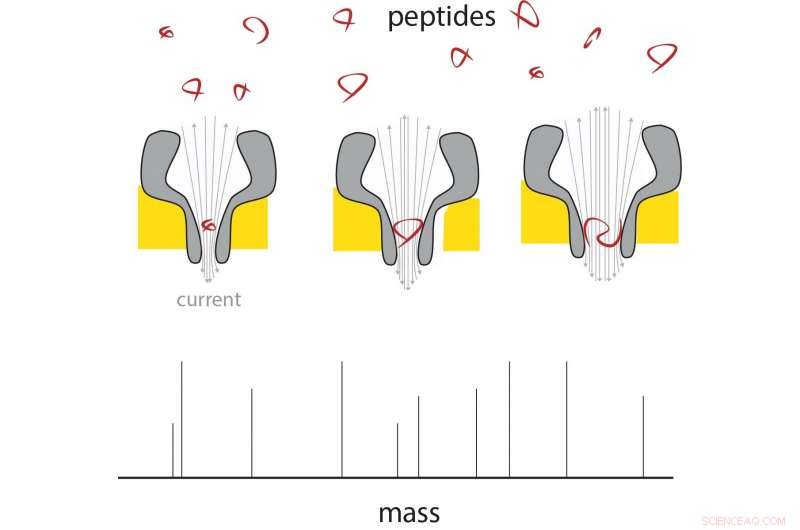
Un péptido entra por el extremo delgado del nanoporo, y cambia la corriente en proporción a su masa. Mediante el uso de nanoporos de diferentes tamaños, se puede medir una variedad de tamaños de péptidos. Crédito:G. Maglia / Universidad de Groningen
Los científicos de la Universidad de Groningen han desarrollado nanoporos para medir directamente la masa de péptidos. Aunque la resolución necesita mejorar, Esta prueba de principio muestra que se puede construir un espectrómetro de masas de péptidos barato y portátil utilizando la tecnología de nanoporos existente y los poros patentados que se desarrollaron en el laboratorio del Profesor Asociado de Biología Química de la Universidad de Groningen. Giovanni Maglia. Se publicó un artículo sobre este descubrimiento en Comunicaciones de la naturaleza el 19 de febrero.
Los espectrómetros de masas son invaluables para estudiar proteínas, pero son voluminosos y caros, lo que limita su uso a laboratorios especializados. "Todavía, la próxima revolución en los estudios biomédicos será la proteómica, el análisis a gran escala de proteínas que se expresan en diferentes tipos de células, ", dice Maglia. Aunque cada célula de tu cuerpo lleva el mismo ADN, la producción de proteínas difiere enormemente entre los tipos de células. "Y también, las proteínas se modifican después de su producción, por ejemplo, agregando azúcares que pueden afectar su función ".
Masa
La tecnología de nanoporos podría ofrecer una forma de analizar moléculas individuales. En trabajos anteriores, Maglia ya demostró que los nanoporos biológicos se pueden utilizar para medir metabolitos e identificar proteínas y péptidos. Estos poros son grandes estructuras proteicas, incorporado en una membrana. Las moléculas que entran en un poro o lo atraviesan provocan un cambio en la corriente eléctrica a través del poro. "Un problema al medir la masa de péptidos es que pasan demasiado rápido incluso por el poro biológico más pequeño para obtener una lectura, "explica Maglia.
Hacer poros más pequeños fue un desafío. "Los poros están formados por varios monómeros, así que inicialmente modificamos la interacción entre estos monómeros, pero eso no funcionó ". La observación de que mezclar monómeros con grandes cantidades de lípidos, que forman la membrana, dio como resultado un mayor porcentaje de poros más pequeños, le dio a Maglia y su equipo la idea de modificar la interacción entre monómeros y lípidos. de hecho resultó en poros formados por un número menor de monómeros, que redujo el tamaño de los poros.
Los poros más pequeños de la historia
Maglia pudo entonces producir poros en forma de embudo que, en su extremo estrecho, solo mide 0,84 nanómetros. "Estos son los poros biológicos más pequeños jamás producidos". El siguiente desafío fue asegurar que los péptidos pasaran a través de los poros, independientemente de su composición química. "Los poros tienen una carga negativa, que es necesario para su correcto funcionamiento, "explica Maglia.
La carga hace que el agua fluya a través del poro, arrastrando los péptidos. Pero los péptidos cargados negativamente serían repelidos por la carga negativa en el extremo delgado del embudo. Maglia modificó la carga alterando la acidez de los fluidos utilizados. "Finalmente, logramos encontrar las condiciones adecuadas estableciendo la acidez en un pH de exactamente 3.8. Esto permite que los péptidos cargados negativamente pasen mientras se mantiene un flujo de agua lo suficientemente grande a través de los poros ".
Resolución
Las mediciones a través de nanoporos de diferentes tamaños muestran que la corriente eléctrica es lineal con el volumen del péptido que la atraviesa. Estos péptidos tenían una longitud de 4 a 22 aminoácidos. La diferencia entre los aminoácidos alanina y glutamato podría medirse en este sistema, lo que significa que la resolución es de alrededor de 40 Dalton (una medida para la masa de proteínas). "La resolución de los espectrómetros de masas convencionales es mucho mejor, pero si pudiéramos hacer que el sistema fuera cuarenta veces más sensible, ya sería útil en la investigación proteómica, "dice Maglia. Hay varias formas de mejorar la resolución, dice Maglia. "Podríamos diseñar el nanoporo con aminoácidos artificiales, o utilizar diferentes iones en nuestras soluciones, reducir el ruido cambiando la temperatura, etc. "
El sistema de nanoporos tiene varios puntos de venta únicos:mide moléculas individuales, la tecnología en sí ya está disponible comercialmente y es relativamente barata. Es más, el sistema nanopore es portátil. Y, mediante el uso de muchos poros diferentes en un dispositivo, puede medir simultáneamente péptidos de diferentes tamaños e incluso modificaciones de péptidos. "Todo esto significa que es factible un espectrómetro de masas versátil y económico para el análisis de péptidos, ", dice Maglia." Y eso significaría que más laboratorios podrían permitirse realizar estudios proteómicos muy importantes ".