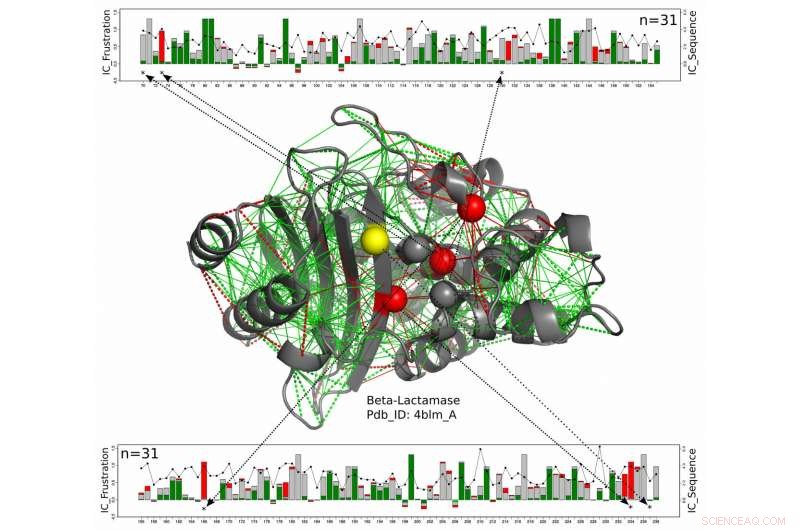
En este modelo estructural para una proteína beta-lactamasa, Los residuos catalíticos se muestran como esferas con aquellos que están constantemente altamente frustrados a lo largo de toda la familia de beta-lactamasa mostrados en rojo y aquellos para los que el estado frustrado no se conserva en amarillo. El nuevo trabajo de científicos de la Universidad Rice, la Universidad de Buenos Aires y el Laboratorio Europeo de Biología Molecular sugiere estas enzimas, que deben permanecer expuestos para reaccionar con sus objetivos, obtener una medida de protección de los aminoácidos algo frustrados que los rodean. Las líneas verdes representan una frustración mínima, las líneas rojas representan una gran frustración. Los gráficos lineales en la parte superior e inferior muestran las posiciones de los aminoácidos relevantes en la cadena de proteínas y una medida de la conservación de energía en toda la familia de proteínas beta-lactamasas. Crédito:Maria Feiberger / Universidad de Buenos Aires
Las proteínas se pliegan de acuerdo con un guión escrito en el patrón de sus aminoácidos. Pero para funcionar correctamente, algunas partes deben improvisar.
Los sitios activos de las enzimas, proteínas que aceleran y guían reacciones bioquímicas, hacer la vida posible. Para hacer esto, sus instrucciones tienen que entrar en conflicto con el plan estructural general de la proteína, según científicos de la Universidad de Rice, la Universidad de Buenos Aires y el Laboratorio Europeo de Biología Molecular en Heidelberg, Alemania.
Según los investigadores, La evolución ha seleccionado partes de las enzimas como lo suficientemente importantes como para permitir que se desvíen enérgicamente de las instrucciones que conducen a un embudo plegable. que guía a las proteínas a sus estados funcionales de baja energía. Examinando esencialmente todas las enzimas conocidas, los investigadores también confirmaron la sospecha de que niveles adicionales de interacciones más débilmente frustradas rodean y apoyan los sitios catalíticos mismos.
La teoría detallada en las Actas de la Academia Nacional de Ciencias extiende el principio aceptado de frustración mínima que explica por qué las proteínas pueden progresar sin problemas desde las secuencias lineales originalmente codificadas en su ADN hasta su funcionamiento. formas globulares tridimensionales. Este principio reconoce el hecho de que la frustración a menudo no se resuelve cuando el conflicto energético restante sirve de alguna manera a la función de la proteína.
Según Peter Wolynes de Rice, quien enunció el principio en forma matemática hace más de 20 años, los paisajes energéticos de las proteínas con partes catalíticas merecen un análisis adicional, dada la importancia que la evolución les ha asignado.
"Una molécula perfectamente plegada, no importa lo hermosa que sea una escultura, no puedo hacer mucho, ", dijo." Tienes que tener una proteína que, mientras que en su mayoría está doblado, todavía tiene algunas bisagras frustradas que son incompatibles con el plegado, pero que son necesarias para permitir el movimiento requerido para las reacciones químicas ".
La frustración a nivel atómico es fácil de experimentar:simplemente empuje los polos positivos de dos imanes juntos y sienta cómo retroceden. Como imanes los aminoácidos de una proteína plegable se atraen y repelen entre sí, ya que (en su mayoría) resuelven conflictos y finalmente llegan a formar una disposición estable de contactos.
"Ahora agregue un tercer imán, y puede encontrar una frustración de la que no puede deshacerse, "dijo el coautor Wolynes, quien trabajó con el equipo de Buenos Aires dirigido por el químico biológico Diego Ferreiro, un ex investigador postdoctoral en su grupo.
El nuevo estudio muestra que la frustración entre los aminoácidos vecinos de la enzima, como en la situación con el tercer imán, actúa para ayudar a la enzima frustrada a mantenerse firme. Sigue siendo algo inestable pero tiene regiones disponibles para unirse y modificar las moléculas diana.
Claramente, Wolynes dijo:La evolución tiene prioridades que superan la estética de lograr un pliegue perfecto.
El equipo de investigación examinó computacionalmente cientos de estructuras proteicas conocidas y descubrió que familias enteras de enzimas comparten firmas características de frustración en el sitio activo que se extienden a la segunda y tercera capas de aminoácidos. o conchas, alrededor de la enzima.
"Lo interesante que encontramos fue que la frustración generalmente se extiende más allá del primer caparazón absoluto, ", dijo." Eso significa que hay una sutileza incómoda pero necesaria en las limitaciones funcionales que requiere hacer bien estos tres proyectiles ".
Wolynes señaló que la premio Nobel Frances Arnold y otros que estudian la evolución artificial en el laboratorio han visto evidencia de una frustración extendida en sus esfuerzos por modificar enzimas para reacciones novedosas.
"A veces, cambiaban específicamente el sitio activo para catalizar diferentes reacciones químicas de las naturales, pero descubrió que los aminoácidos distantes del sitio activo también necesitaban cambiar para que la enzima funcionara de manera eficiente, ", dijo." No era obvio por qué, pero los modelos muestran que los cambios en la segunda y tercera capa mejoran la capacidad catalítica de las enzimas.
"Así que nuestros resultados no fueron una sorpresa total, pero es bueno ver que la frustración extendida es bastante frecuente en la naturaleza y es un tema común en todas las clases de enzimas conocidas, " él dijo.