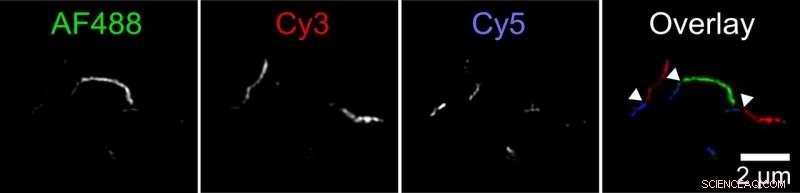
Los biofísicos han descubierto un nuevo mecanismo por el cual los agregados de proteína tau, llamadas fibrillas, puede crecer. Dos fibrillas se pueden unir de un extremo a otro. Esta figura muestra una fibrilla compuesta de fibrillas más pequeñas etiquetadas en tres colores. El investigador marcó las proteínas tau con tres tintes fluorescentes diferentes y les permitió agregarse en tubos de ensayo separados. Luego mezcló estas fibrillas de diferentes colores en un cuarto tubo de ensayo. Las imágenes tomadas con un microscopio de fluorescencia de superresolución mostraron fibrillas largas con secciones cortas de cada color, lo que indica que las fibrillas de los tubos de ensayo originales deben tener extremos unidos para formar fibrillas más largas. Crédito:Carol Huseby / Universidad Estatal de Ohio
Al principio del curso de la enfermedad de Alzheimer, mucho antes de que los pacientes futuros comiencen a notar los síntomas, comienzan a formarse ovillos neurofibrilares compuestos de agregados de proteína tau en sus células cerebrales. Qué tan tóxicos son estos agregados y qué tan bien se propagan dependen de su tamaño. Sin embargo, Los científicos que estudian la formación de enredos no han podido explicar por qué aparecen en las enfermedades diferentes tamaños de agregados de tau similares a cables.
Pero ahora, investigadores de la Universidad Estatal de Ohio han descubierto que en lugar de agregar solo una proteína a la vez, las fibrillas de varias longitudes se pueden unir de un extremo a otro para crear un filamento más largo. El hallazgo, que aparecerá en el Revista de química biológica los lunes, ayuda a explicar cómo las fibrillas pueden crecer a cientos de nanómetros y también podría ayudar a los investigadores a comprender los mecanismos de un grupo emergente de candidatos a fármacos diseñados para inhibir la agregación de tau.
Los científicos pueden utilizar modelos matemáticos para describir procesos biológicos como la formación de fibrillas. Un modelo simple común de agregación de tau incluye dos pasos. En el primer paso dos proteínas tau se unen lentamente, y, en el segundo paso, moléculas de tau adicionales se adhieren rápidamente.
Primera autora Carol Huseby, un estudiante de posgrado en el laboratorio de Jeff Kuret, trabajando en colaboración con Ralf Bundschuh, se propuso expandir este modelo matemático para incluir otras formas conocidas en que se comportan las fibrillas de tau. Los científicos han observado, por ejemplo, que a veces una fibrilla se fragmenta en dos. Otros tiempos, una nueva fibrilla puede nuclearse en medio de una fibrilla existente.
El modelo simple de dos pasos predijo que un tubo de ensayo lleno de proteína tau purificada daría como resultado una gran cantidad de fibrillas cortas. Pero Huseby sabía que cuando los investigadores observan la proteína tau agregada bajo un microscopio, ven un número menor de fibrillas largas. Esa discrepancia sugirió que algo estaba sucediendo en el mundo real que no se había tenido en cuenta en el modelo. Plantearon la hipótesis de que quizás las fibrillas cortas podrían adherirse de un extremo a otro para alargarse.
Huseby realizó una serie de experimentos para probar la hipótesis. En uno, primero marcó las proteínas tau con tres colores fluorescentes diferentes y les permitió agregarse en tubos de ensayo separados. Luego mezcló estas fibrillas de diferentes colores en un cuarto tubo de ensayo.
Las imágenes tomadas con un microscopio de fluorescencia de superresolución mostraron fibrillas largas con secciones cortas de cada color, lo que indica que las fibrillas de los tubos de ensayo originales deben tener extremos unidos para formar fibrillas más largas. Los experimentos de control establecieron que esto no puede explicarse por la preferencia de las moléculas etiquetadas por etiquetas similares.
Después de que Huseby incorporó este nuevo mecanismo al modelo, produjo una descripción mucho mejor de lo que realmente hacían las proteínas tau purificadas cuando formaban agregados. Este estudio es el primero en demostrar que las fibrillas pueden alargarse en más de una proteína tau a la vez.
Los investigadores de la enfermedad de Alzheimer todavía están tratando de discernir si las fibrillas de tau son una causa o simplemente un efecto de la enfermedad. Una posibilidad es que la transmisión de fibrillas de una célula a otra contribuya a la propagación de enfermedades en el cerebro. Una fibrilla muy larga según Kuret, es poco probable que se propague de esta manera. "Pero una vez que se rompe en pequeños pedazos, esos pueden difundirse, facilitando su movimiento de una célula a otra ".
Este estudio utilizó solo un tipo de tau. Se conocen seis isoformas de diferente longitud, y la fosforilación y otros cambios aumentan la complejidad de la proteína. Los investigadores planean incorporar estas variables en trabajos futuros, y comenzar a utilizar el modelo para comprender cómo los inhibidores de tau cambian el comportamiento de los agregados de proteínas.