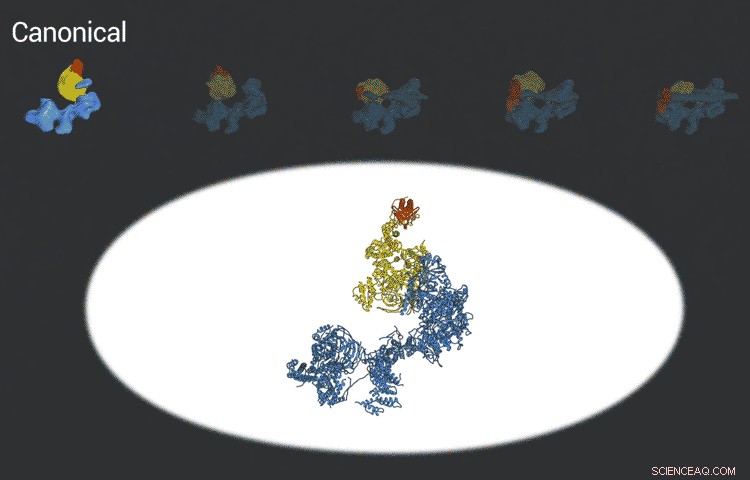
El complejo del factor de transcripción IID se fija al ADN, comprueba que está en el lugar correcto y luego recluta otras proteínas para comenzar a transcribir el ADN en ARN. Los nuevos avances en cryo-EM permitieron a los investigadores definir cinco conformaciones distintas de TFIID a medida que se bloquea y carga. Crédito:Laboratorio Eva Nogales
Llevando los límites de la microscopía crioelectrónica, Universidad de California, Berkeley, Los científicos han capturado fotogramas congelados de la forma cambiante de una molécula enorme, una de las máquinas moleculares clave del cuerpo, ya que se fija al ADN y carga la maquinaria para leer el código genético.
La molécula, llamado factor de transcripción IID, es fundamental para la transcripción de genes en ARN que luego se utilizará como planos para producir proteínas. Debido a sus muchas partes móviles y su gran tamaño, sin embargo, La estructura 3-D de TFIID ha sido difícil de capturar:las partes móviles se vuelven borrosas.
Cryo-EM, una técnica de imagen cuyos descubridores obtuvieron el Premio Nobel de Química 2017, es la única forma de obtener una instantánea de voluminosos, estructuras de disquete como esta. La información estructural de alta resolución es esencial para comprender cómo TFIID traduce las instrucciones operativas en nuestro genoma y cómo a veces se vuelve loco.
El nuevo, Instantáneas más detalladas de las partes móviles de la molécula podrían ayudar a los diseñadores de fármacos a crear fármacos que interfieran con los cambios estructurales de la molécula para modificar la expresión de un gen que está causando una enfermedad.
"Estas estructuras te dan el potencial para diseñar de forma racional pequeñas moléculas que alterarán la función normal, porque ahora no tenemos una sola estructura, tenemos muchas estructuras, que es aún más poderoso porque podemos orientar el movimiento que estamos viendo en este momento, "dijo Eva Nogales, profesor de biología celular y molecular de UC Berkeley y científico de la facultad en el Laboratorio Nacional Lawrence Berkeley.
Nogales y sus colegas, más prominentemente los estudiantes graduados de UC Berkeley Avinash Patel y Robert Louder, publicó sus hallazgos en línea esta semana antes de la publicación impresa en la revista Ciencias .
"Dónde se coloca esa droga y cómo se hace que esa droga opere depende en gran medida de la naturaleza transitoria de estas estructuras, y eso es algo de lo que nos hemos dado cuenta recientemente, "dijo Robert Tjian, un profesor de biología molecular y celular de UC Berkeley que descubrió el TFIID y ha trabajado en la molécula durante gran parte de su carrera, aunque no fue coautor del nuevo artículo. "Debido a que estas moléculas se mueven y sus estructuras son tan complicadas, El descubrimiento de fármacos convencionales nunca revelaría lo que está sucediendo. Las estructuras de Eva van a cambiar eso. Esto tiene el potencial de abrir el universo de objetivos drogadictos ".
Congelar moléculas
TFIID es una aglomeración de más de una docena de proteínas distintas que se ubica en un promotor, una región de ADN que controla la transcripción de un gen cercano, y prueba la secuencia para asegurarse de que haya aterrizado en el lugar correcto. Una vez confirmado esto, se abre para reclutar docenas de otras proteínas que luego comienzan a moverse a lo largo del gen, utilizando la secuencia de ADN como plantilla para crear una secuencia complementaria de ARN, llamado ARN mensajero. Esto luego sale del núcleo hacia el cuerpo de la célula, donde es traducida por otras máquinas moleculares en proteína.
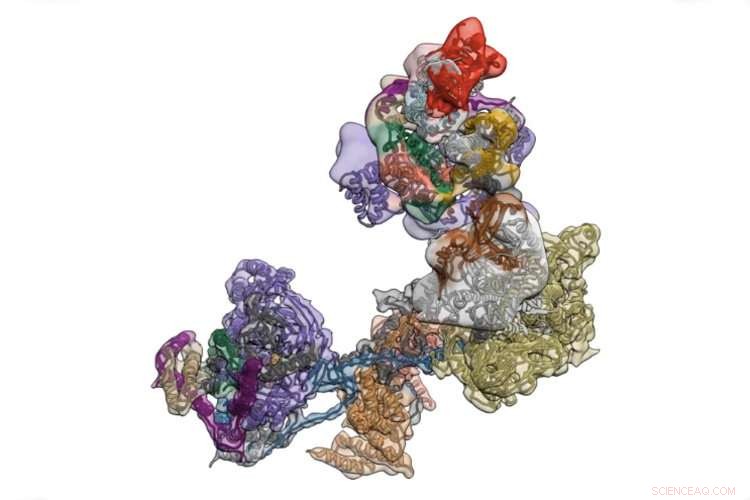
TFIID es un complejo de proteínas que inicia la transcripción de las instrucciones de funcionamiento del cuerpo codificadas en el ADN. Crédito:Universidad de California - Berkeley
"TFIID es probablemente la estructura más difícil que nadie haya intentado resolver, porque es masivo y muy flexible, "dijo Tjian." La única forma de ver estas estructuras tan flexibles es mediante crio-EM, y Eva ahora puede congelar todos estos diferentes estados flexibles y describir el movimiento ".
Cryo-EM implica congelar una gota que contiene millones de copias de una molécula, en todas las orientaciones imaginables, y el uso de un microscopio electrónico para determinar la estructura mediante la combinación de imágenes para definir la forma tridimensional. Debido a que el TFIID tiene muchas partes móviles, ya que se une al ADN y se prepara para transcribir un gen, promediar todas las posiciones congeladas produce una imagen borrosa.
Nogales compara los esfuerzos anteriores para obtener imágenes de TFIID, incluidos sus propios intentos que se remontan a casi 20 años, a tomar una fotografía de un equipo de fútbol en el campo y promediar los movimientos de todos los jugadores. El resultado es un torso humano genérico con la cabeza y las extremidades borrosas.
Imágenes del campo de fútbol
Ahora, gracias a más de dos años de trabajo intensivo de Patel y Louder, Es posible capturar imágenes de mayor resolución que son similares a distinguir la patada de pierna de un delantero del bloqueo de mano de un portero y el cabezazo de un zaguero.
"Imagina que tienes una imagen de los 22 jugadores de fútbol en el campo, y debía combinarlos en una sola unidad que llamaría "jugador de fútbol genérico, '", dijo." Se verá como una imagen borrosa, apenas se puede ver que es una forma humanoide y que hay algún tipo de movimiento, pero no te darías cuenta de que existe una diferencia entre los jugadores ".
Las imágenes mejoradas son el resultado de mejores detectores desarrollados originalmente por colegas de Berkeley Lab, y la mejora constante de los algoritmos informáticos para analizar las enormes cantidades de datos recopilados por los detectores. Esto ayudó a Nogales y su equipo a definir cinco estructuras distintas de la molécula TFIID.
"They span the whole binding sequence:before binding to the DNA, initial binding to the promoter, subsequent binding after it double checks that this is the right place, and the final state, " Nogales said.
She and her colleagues continue to push the limits of cryo-EM, hoping to determine the 3-D structure of TFIID after other transcription proteins land on it to complete the transcription process.