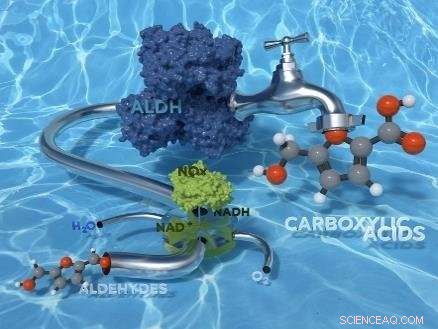
Imagen de portada de la actual edición de Green Chemistry con la investigación de HIMS / Biocat.
Investigadores del Instituto Van't Hoff de Ciencias Moleculares (HIMS) de la Universidad de Ámsterdam han desarrollado el primer proceso "verde" biocatalítico viable para la oxidación quimioselectiva de aldehídos en ácidos carboxílicos. El artículo que describe la investigación aparece en la edición actual de la revista. Química verde .
La oxidación de aldehídos a ácidos carboxílicos es una reacción química importante e industrialmente relevante, por ejemplo, con respecto a la síntesis de productos farmacéuticos y polímeros de base biológica. Los procedimientos de oxidación actuales requieren el uso abundante de reactivos químicos tóxicos y a menudo producen productos secundarios no deseados.
En busca de la mejora de la huella medioambiental de la oxidación de aldehídos, Se han investigado varios métodos sintéticos novedosos. Hasta ahora, sin embargo, no se ha desarrollado ningún procedimiento económicamente viable que se base en reactivos y / o disolventes ambientalmente benignos, y que combina una productividad elevada con una selectividad perfecta (lo que significa que solo se oxidan los grupos funcionales aldehído deseados, minimizando así o incluso evitando por completo la formación de productos secundarios no deseados).
Biocatálisis benigna
Como alternativa 'verde' interesante, biocatalítico, Los métodos basados en enzimas para la oxidación de grupos funcionales presentan condiciones de reacción suaves (temperatura ambiente y presión atmosférica) en un ambiente acuoso. y generalmente alcanzan muy buenas selectividades. Es más, pueden utilizar oxígeno molecular como oxidante benigno.
El equipo de investigación de HIMS dirigido por DrFrancesco Mutti ahora ha explorado con éxito el uso de enzimas aldehído deshidrogenasa para la oxidación de aldehídos a ácidos carboxílicos. En un artículo aceptado recientemente por la revista RSC de alto impacto Química verde , los investigadores presentan un estudio sobre tres aldehído deshidrogenasas recombinantes procedentes de lentes bovinos y las bacterias Escherichia coli y Pseudomonas putida. Para la regeneración de la coenzima catalítica NAD +, aplicaron la H 2 O formando NAD-oxidasa de Streptococcus mutans. La biooxidación final se realiza en tampón fosfato acuoso, en condiciones de reacción suaves (40 ° C y presión atmosférica) y consume solo dioxígeno del aire como oxidante.
Estudio extenso
Para investigar el potencial de las tres enzimas, los investigadores realizaron un estudio extenso en el que probaron sesenta y un aldehídos estructuralmente diversos. La mayoría de estos sustratos (alifáticos, aril alifático, bencílico-, aldehídos heteroaromáticos y bicíclicos) se convirtieron con rendimientos superiores al 60% y en muchos casos incluso superiores al 99%. Las únicas excepciones fueron algunos benzaldehídos orto-sustituidos y dos aldehídos heteroaromáticos bicíclicos.
En todos los casos, la quimioselectividad fue perfecta:no se detectó ningún otro producto excepto el ácido carboxílico esperado. Esto significa que otras funcionalidades oxidables (como el resto hidroxilo, grupos de alquenos, grupos arilo, y los heteroátomos de azufre y nitrógeno) permanecieron intactos.
Células enteras
Dado que para aplicaciones prácticas se prefiere el uso de células completas en lugar de enzimas purificadas, evitando pasos de purificación costosos y que consumen mucho tiempo, los investigadores también investigaron la biooxidación con E. coli liofilizó células completas así como células en reposo. Resultó que la suplementación de coenzima NAD + y enzima de reciclaje de NOx se puede omitir en algunos casos ya que el huésped microbiano produce una cantidad suficiente de coenzima, que puede ser reciclado por enzimas endógenas de E. coli.
Los investigadores concluyen que las aldehídos deshidrogenasas tienen el potencial de convertirse en la primera opción para la oxidación quimioselectiva de aldehídos en grupos carboxílicos. Su método biocatalítico es particularmente atractivo para la oxidación de restos de aldehído dentro de moléculas que poseen otros grupos oxidables. La investigación futura se centrará en mejorar la tolerancia de las enzimas a la concentración de sustrato y la estabilidad a largo plazo para permitir una aplicación aún más amplia de estas enzimas.