
Un monocristal de hielo se visualizó simultáneamente mediante microscopía de campo brillante (izquierda) e interferometría de Mach-Zehnder (derecha) para observar su morfología y tasas de crecimiento, respectivamente. Crédito:Bayer-Giraldi M. et al., Actas de la Academia Nacional de Ciencias , 2 de julio, 2018
Los científicos han descubierto que una proteína fijadora de hielo (fcIBP) de una microalga de hielo marino no encaja en la clasificación convencional de proteínas fijadoras de hielo. sugiriendo mecanismos desconocidos detrás de su propiedad anticongelante. Este hallazgo podría conducir a una aplicación más amplia de la proteína anticongelante en las industrias alimentaria y médica.
Los organismos que viven en zonas frías producen proteínas que se unen al hielo (anticongelantes) para evitar morir congelados. Estas proteínas se han clasificado en dos grupos; el tipo hiperactivo se adhiere a las caras basales hexagonales de los cristales de hielo para inhibir el crecimiento de los cristales de hielo y reduce la temperatura de congelación hasta en seis grados C, mientras que el tipo moderado no se adhiere a las caras basales y reduce la temperatura de congelación en no más de 1 grado C.
"Muchos estudios sobre proteínas que se unen al hielo se han centrado en perspectivas bioquímicas, pero estas proteínas solo se han investigado recientemente desde el punto de vista de la física del crecimiento de cristales, "dice el profesor Gen Sazaki del equipo de investigación de la Universidad de Hokkaido.
Los investigadores utilizaron su cámara original, desarrollado en el Instituto de Ciencias de Baja Temperatura de la Universidad de Hokkaido, que les permitió observar en detalle el crecimiento de cristales de hielo en el agua. Se observó al microscopio la morfología de los cristales de hielo a los que se había unido fclBP y se midieron con precisión sus tasas de crecimiento.
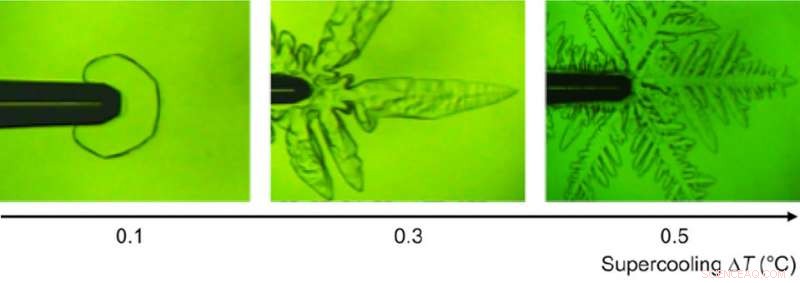
Monocristales de hielo a diferentes temperaturas de súper enfriamiento observados bajo un microscopio. Crédito:Bayer-Giraldi M. et al., Actas de la Academia Nacional de Ciencias , 2 de julio, 2018
"Para nuestra sorpresa, descubrimos que fclBP, que se sabe que es eficaz para reducir el punto de congelación en menos de 1 grado C, se adhiere tanto a las caras basales como a las del prisma, afectando así el crecimiento de los cristales de hielo, "dice la Dra. Maddalena Bayer-Giraldi, primer autor del Instituto Alfred-Wegener, Centro Helmholtz de Investigaciones Polares y Marinas (AWI). Cuando la temperatura del agua no era muy baja, se inhibió el crecimiento de cristales y los cristales de hielo se facetaron, apareciendo como placas hexagonales, un fenómeno nunca visto en cristales de hielo en agua pura. Cuando la temperatura del agua era suficientemente baja, los cristales de hielo tomaron una forma de dendrita normal. Pero debido a que fclBP suprimió el crecimiento de cristales de hielo en las caras del prisma, las ramas dendríticas se hicieron más estrechas, permitiendo la liberación más fácil de calor y por lo tanto el crecimiento más rápido de las puntas de las ramas de cristal.
El estudio mostró que el fclBP se adhiere a las caras basales y prismáticas de los cristales de hielo, aunque es capaz de reducir el punto de congelación en menos de 1 grado C aproximadamente. desafiando la clasificación convencional de proteínas que se unen al hielo. "Las funciones de las proteínas que se unen al hielo no pueden evaluarse únicamente mediante la unión de las proteínas a las caras basales o mediante la inhibición del crecimiento de los cristales de hielo. Necesitamos comprender los mecanismos moleculares detrás de sus propiedades anticongelantes. Una mayor comprensión de las proteínas que se unen al hielo podría conducir a su aplicación en la conservación de alimentos y órganos vivos, así como en criocirugía, "dice la Dra. Maddalena Bayer-Giraldi.