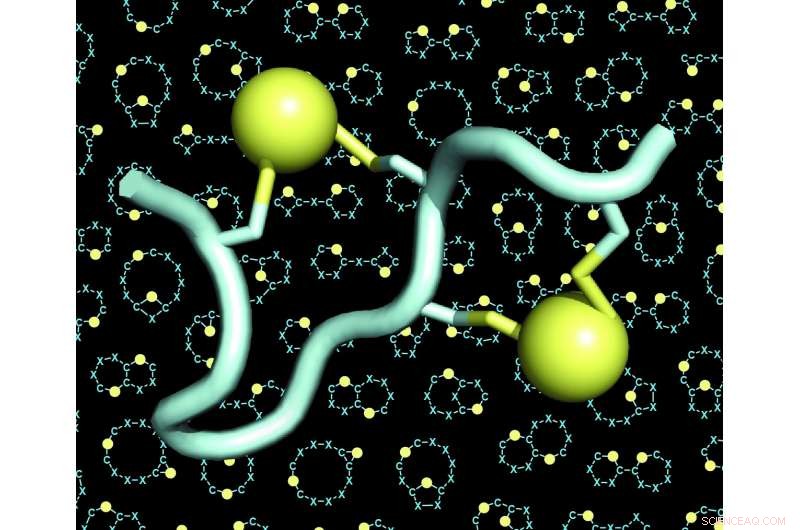
Un modelo de un péptido de doble puente (el péptido en azul claro, los dos puentes en amarillo). El fondo de las figuras muestra muchos ejemplos de esqueletos (también llamados 'andamios' o 'espinas dorsales') de péptidos de doble puente. Crédito:C. Heinis / EPFL
Los péptidos son cadenas cortas de aminoácidos que pueden unirse a proteínas y cambiar su función. Muestran una alta afinidad de unión, baja toxicidad, y son fáciles de sintetizar, todo lo cual hace que los péptidos sean ideales para su uso en el desarrollo de fármacos, y muchos péptidos naturales como la insulina, oxitocina, somatostatina y los antibióticos vancomicina o polimixina B, son ampliamente utilizados.
Sin embargo, el uso de péptidos como fármacos se enfrenta a dos desafíos. Primero, afinidad de unión:una buena unión requiere arquitecturas de péptidos difíciles y secuencias de aminoácidos que sean perfectamente complementarias en forma y carga a la superficie de sus proteínas diana. Segundo, estabilidad de péptidos:los péptidos pueden potencialmente ser cortados por enzimas (proteasas) en fragmentos inútiles o incluso aminoácidos individuales.
El laboratorio de Christian Heinis en EPFL ahora ha abordado estos dos desafíos desarrollando el nuevo formato de péptidos que ellos llaman "péptidos de doble puente". Estas son cadenas de 10 a 15 aminoácidos, cuatro de los cuales están conectados químicamente por dos puentes. Cada puente une un par de dos aminoácidos de cisteína, cuatro en total.
Debido a que las cuatro cisteínas se pueden colocar en muchas configuraciones diferentes a lo largo de la secuencia de aminoácidos, la estrategia de doble puente permitió a los investigadores generar una enorme cantidad de arquitecturas de péptidos estructuralmente diversas. Expandieron la diversidad aún más mediante el uso de diferentes reactivos químicos que aumentaron el número de puentes. Los científicos también encontraron que las cuatro cisteínas podrían ser puenteadas por dos enlazadores de tres formas diferentes, dando lugar a tres arquitecturas diferentes de cada secuencia de péptidos.
Usando esta estrategia, los investigadores produjeron una enorme diversidad de estructuras peptídicas, todos con diferentes estructuras de "esqueleto". Además, los químicos cambiaron sistemáticamente los aminoácidos entre las cisteínas y generaron bibliotecas de miles de millones de diferentes péptidos de doble puente. Después de seleccionar las bibliotecas, los investigadores pudieron aislar aglutinantes de alta afinidad a importantes objetivos proteicos. Uno de estos objetivos fue la calicreína, una proteína plasmática que se asocia con angioedema hereditario, un trastorno de hinchazón poco común. Otro fue la interleucina-17, una proteína citoquina implicada en varios trastornos inflamatorios como la artritis reumatoide y la psoriasis. Usando el enfoque de doble puente para estos dos objetivos proteicos, los científicos desarrollaron péptidos que podían unirlos de manera eficiente en concentraciones nanomolares. En el caso de la calicreína, los péptidos podrían unirlo durante más de una hora antes de disociarse.
La estabilidad también fue una característica muy atractiva del nuevo formato de péptidos. Los péptidos de doble puente apenas se degradan por las proteasas en la sangre, lo cual es una gran ventaja porque evita que los péptidos se eliminen demasiado rápido, extendiendo así sus efectos terapéuticos. El laboratorio de Heinis ahora está aplicando el formato peptídico a muchas otras enfermedades diana. Ya han desarrollado nuevos, bibliotecas de péptidos de doble puente aún más grandes y las seleccionó frente a una variedad de objetivos relevantes para la enfermedad. Uno de estos péptidos ya está en evaluación preclínica.