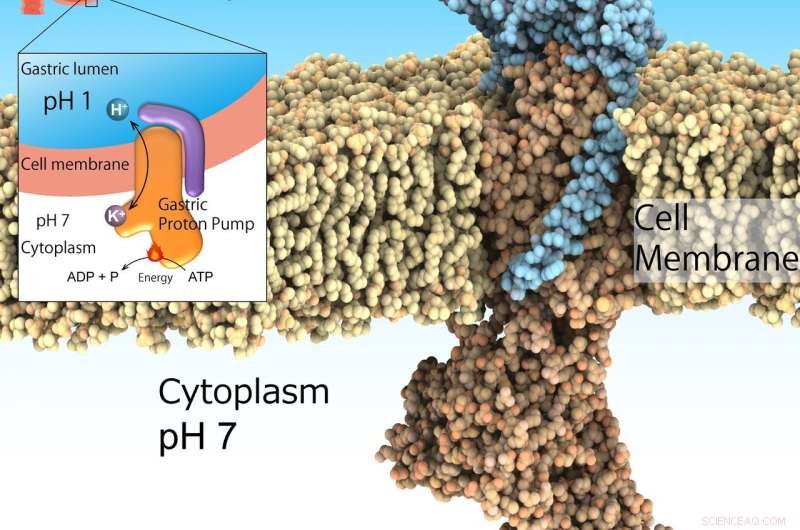
La bomba de protones gástrica, también conocido como H +, K + -ATPase, se expresa en la superficie del estómago para secretar el ácido gástrico indispensable para la digestión de proteínas en los alimentos. Sin embargo, Demasiada secreción de ácido induce úlceras. La bomba de protones gástrica capta protones del citoplasma neutro (pH 7) al medio ácido del estómago (pH 1) impulsado por ATP como fuente de energía. Por lo tanto, es un importante objetivo farmacológico para las enfermedades relacionadas con el ácido. Crédito:Kazuhiro Abe
El ambiente altamente ácido del estómago es esencial para la digestión. Es más, actúa como una barrera importante para los patógenos invasores. Sin embargo, La acidificación excesiva del estómago conduce a úlceras. Aunque esta no es una afección potencialmente mortal, puede perjudicar considerablemente la salud de las personas afectadas. La supresión de ácido en combinación con antibióticos es el tratamiento reconocido para erradicar la bacteria Helicobacter pylori, un factor de riesgo de cáncer gástrico. Este ambiente de pH1 está regulado por el H gástrico + , K + -ATPase, una clase de enzimas que catalizan H + transporte desde la solución citosólica neutra (pH 7) al lumen gástrico ácido (pH 1) alimentado por la fuente de energía celular ATP. Por eso, H gástrico + , K + -ATPase es un objetivo destacado para los medicamentos que tratan el exceso de secreción de ácido del estómago.
La principal pregunta de investigación en esta área de estudio es cómo se puede lograr un ambiente tan ácido en el estómago. Para abordar esta pregunta, los investigadores buscaron la estructura de H + , K + -ATPase. El equipo publicó recientemente sus hallazgos en Naturaleza .
"En nuestro estudio, utilizamos cristalografía de rayos X para determinar las estructuras de H gástrico + , K + -ATPasa unida a dos inhibidores de la bomba de protones, vonoprazan y SCH28080, ", explica el primer autor Kazuhiro Abe." Esta información es importante tanto para el perfeccionamiento de los fármacos existentes como para el descubrimiento de nuevos fármacos ".
La cristalografía de rayos X es una técnica que utiliza patrones de difracción de rayos X para determinar estructuras tridimensionales de moléculas como proteínas, pequeñas moléculas orgánicas, y materiales.
El equipo resolvió con éxito la estructura cristalina de H + , K + -ATPasa en complejo con vonoprazan o SCH28080 a una resolución de 2.8 Å, lo suficientemente alto como para revelar que los fármacos se superpusieron parcialmente pero tenían modos de unión claramente distintos en sus sitios de unión que se encuentran en el medio de un conducto que va desde la luz gástrica hasta el catión -sitio de unión.
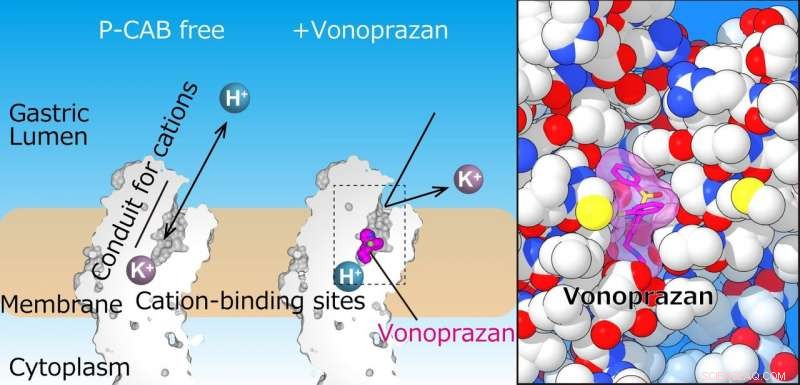
La bomba de protones gástrica exporta H + a la luz gástrica, que sigue a la absorción de K + en el citoplasma. El panel de la izquierda muestra cortes del dominio transmembrana de la bomba de protones gástrica. En la estructura actual, P-CAB (vonoprazan, magenta) se une en medio de la vía de transporte de cationes (conducto), que bloquea el transporte de cationes. La vista ampliada del sitio de unión de vonoprazan (magenta) revela su fuerte unión a la proteína (derecha). Crédito:Kazuhiro Abe
"Las estructuras cristalinas sugieren que la configuración ajustada en el sitio de unión del catión reduce el valor de pKa (una medida de la fuerza del ácido) del ácido glutámico en el residuo 820 lo suficiente como para permitir la liberación de un protón incluso en el entorno de pH 1 del estómago, ", dice el autor principal Yoshinori Fujiyoshi." Estas estructuras definen la interacción molecular entre los P-CAB (K + -bloqueantes de ácido competitivos) y H + , K + -ATPase, y revela cómo H + , K + -ATPase expulsa H + en el estómago incluso a pH 1. Dicha información contribuirá significativamente a la base de conocimientos para el descubrimiento de fármacos para afecciones relacionadas con la acidificación excesiva del estómago ".
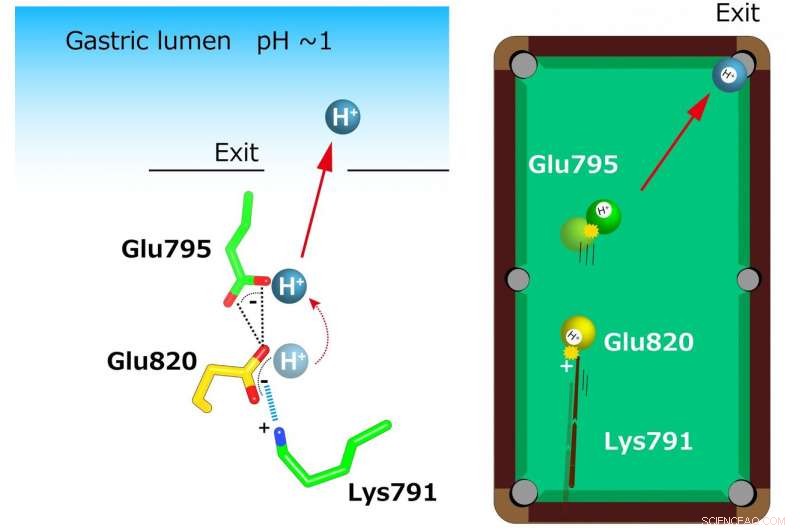
En la estructura cristalina se reveló una coordinación inusualmente estrecha de dos glutamatos (Glu795 y Glu820) y una lisina (Lys791) en el sitio de unión del catión. Un solo H + unido a Glu820 es extruido por la carga positiva de Lys791, incluso para la luz gástrica altamente ácida (izquierda). Este mecanismo se compara con un modelo de billar (derecha). Una carga positiva en el residuo de lisina actúa como una "señal" que dispara la "bola amarilla" (H +) en Glu820. Esta bola amarilla a su vez golpea otra H + (bola verde) en Glu795 que está expuesta a la vía de transporte de cationes. Finalmente, una sola bola (H +) está en el bolsillo (salida a la luz gástrica). Crédito:Kazuhiro Abe