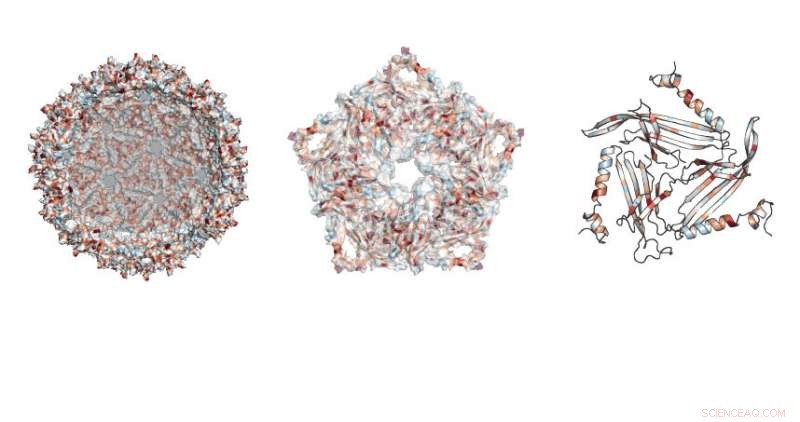
Los investigadores estudiaron dónde se permitían las mutaciones en la estructura similar a una pelota de fútbol hecha por el andamio MS2. Crédito:Universidad Northwestern
Los investigadores de Northwestern Engineering han desarrollado una nueva forma de manipular un caparazón de virus que se autoensambla a partir de proteínas y es prometedor como portador para la detección de enfermedades. entrega de medicamentos, y vacunas.
Los virus tienen caparazones que están diseñados para sobrevivir en condiciones difíciles, protegiendo su carga hasta que encuentren una célula para infectar. La cáscara se puede usar para siempre, sin embargo, porque esa estabilidad lo hace adecuado para proteger cargas más útiles, como medicamentos, que se puede administrar a células específicamente dirigidas.
La investigación se centró en una proteína utilizada por un virus bacteriano llamado bacteriófago MS2. Esta proteína puede autoensamblarse, creando un andamio inofensivo a partir del caparazón viral, dijo Danielle Tullman-Ercek, profesor asociado de ingeniería química y biológica en la Escuela de Ingeniería McCormick.
"En biología, todo tiene su lugar. La biología es genial así, excepto que no conocemos las reglas, ", Dijo Tullman-Ercek." Nuestro descubrimiento fue el método para determinar esas reglas de diseño ".
El estudio, hecho en colaboración con el profesor de química Matthew Francis y sus colegas de la Universidad de California en Berkeley, tomó más de dos años. Los resultados fueron publicados el 11 de abril en la revista Comunicaciones de la naturaleza .
El trabajo permitió a los investigadores examinar qué mutaciones de proteínas específicas rompieron el andamio del virus o cambiaron las propiedades de la estructura. Para hacer eso, el equipo desarrolló una nueva técnica llamada SyMAPS (selección de partículas ensambladas y mutación sistemática), que separó las proteínas de andamio mutadas que permanecieron intactas de las que se rompieron durante la mutación.
En total, el equipo probó casi 2, 600 versiones de la proteína, que forma el caparazón cerrado, andamio similar a una pelota de fútbol.
"La proteína de andamio MS2 tiene 129 posiciones en las que podemos hacer sustituciones, reemplazar el aminoácido existente en esa posición con todos los demás aminoácidos, "dijo Emily Hartman, estudiante de cuarto año de doctorado en química en UC Berkeley y autor principal del artículo. "Al intercambiar los 20 aminoácidos naturales, uno a la vez, en cada posición de la proteína, terminamos probando 20 variables en 129 posiciones ".
El equipo cree que comprender cómo las mutaciones cambian el andamiaje proporciona información importante sobre cómo estas proteínas de virus reutilizadas podrían usarse en medicina.
"El andamio que desea para la administración de medicamentos puede ser diferente al que desea para una vacuna, ", Dijo Tullman-Ercek." Podríamos querer cambiar las propiedades de la carga en la superficie para obtener una mejor orientación o agregar algo al interior de la estructura, como cargarlo con un sensor o una grabadora de diagnóstico ".
Por ejemplo, una estructura que se desmorona en un entorno específico podría ayudar a la administración de medicamentos dirigida, como la quimioterapia.
"Una de las cosas que hicimos en el estudio fue buscar mutantes sensibles al ácido, ", Dijo Hartman." El torrente sanguíneo no es ácido, pero una vez dentro de una célula cancerosa, es mucho más ácido. Si el andamio se deshace en ambientes ácidos, liberaría el fármaco dentro de una célula cancerosa más fácilmente ".
Se encontró una estructura menos tolerante a las condiciones ácidas, y el equipo seguirá trabajando en esta área.
Además, el estudio ofrece información sobre lo que podría surgir naturalmente en un virus mutante, como la influenza. "Esto podría darnos una idea de qué lugares del virus podrían tener una mayor tasa de mutación. Los científicos podrían utilizar esa información para desarrollar nuevas vacunas". "Dijo Tullman-Ercek.
El equipo y sus colegas de ambas universidades utilizarán el trabajo como base de aplicaciones específicas para el andamio viral. ella dijo.
"Este documento es realmente un primer paso en un conjunto más amplio de historias, "Hartman dijo." Hay mucho trabajo en curso en esta colaboración entre las universidades. Estoy emocionado de ver a dónde va.
El estudio se basa en el trabajo anterior de Tullman-Ercek, que encontró que una sola mutación de aminoácido en el mismo andamio de bacteriófago MS2 cambiaba drásticamente su tamaño.
Tullman-Ercek se desempeña como miembro de la facultad dentro del Centro de Biología Sintética de Northwestern. El centro de dos años reúne a científicos de ingeniería, medicamento, física, e informática interesada en manipular la biología para ayudar a la sociedad. Gran parte de la biología sintética se centra en cambiar una célula cambiando su ADN, creando nuevos productos especializados.