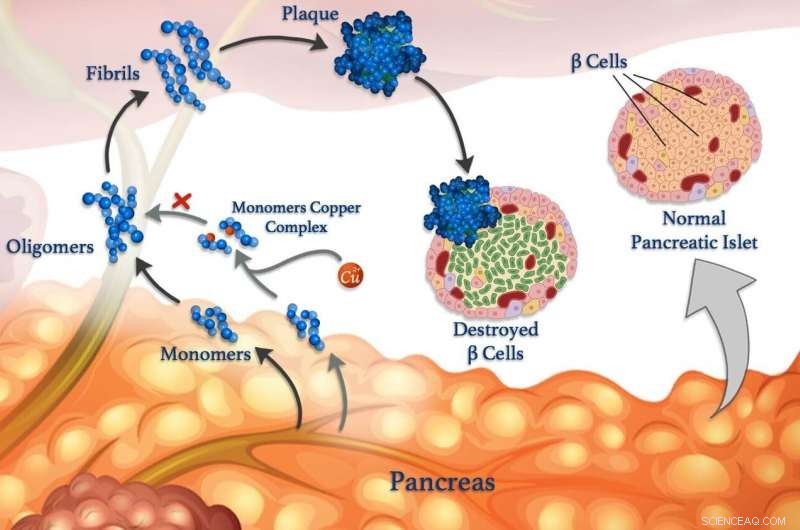
Los iones de cobre (esferas rojas) pueden unirse a los monómeros peptídicos (azules) y evitar que se agrupen para formar oligómeros. fibrillas y placas dañinas. © 2020 Mawadda Alghbly
Desenredar las interacciones entre los iones metálicos y los péptidos en el cuerpo puede eventualmente conducir a mejores tratamientos para la diabetes. Alzheimer y otras enfermedades. Comprender estas interacciones es el foco de la investigación, codirigido por KAUST, eso está revelando cómo los metales, como el cobre, puede afectar la formación de grupos dañinos de grupos de péptidos mal plegados llamados fibrillas, que sustentan muchas enfermedades.
Los péptidos errantes están relacionados con afecciones neurológicas como el Alzheimer, así como para controlar la diabetes. Los niveles de azúcar en sangre normalmente se controlan a través de hormonas peptídicas liberadas por células especializadas llamadas células β. Además de la insulina, las células β sanas también liberan amilina, una hormona peptídica que ayuda a reducir los picos en el nivel de azúcar en la sangre después de comer al ralentizar el vaciado del estómago. Pero la amilina es propensa a formar grumos mal doblados, especialmente en presencia de iones de cobre, que dañan las células β y contribuyen a la diabetes tipo II.
Sin embargo, Los iones metálicos también pueden contrarrestar la agregación de péptidos en algunas circunstancias, dice el investigador de KAUST, Mariusz Jaremko, quien dirigió el trabajo en colaboración con investigadores de la Universidad de Wroclaw en Polonia. Para estudiar el proceso con más detalle, el equipo está examinando la interacción entre los iones de cobre (II) y la amilina y sus análogos moleculares. "Este conocimiento nos daría una idea de los mecanismos moleculares de la diabetes tipo II, permitiéndonos diseñar nuevas estrategias y terapias contra esta enfermedad, "Dice Jaremko.
En su último trabajo, El equipo estudió la influencia de los iones de cobre en la agregación de dos análogos de la amilina humana:un fármaco que imita la amilina llamado pramlintida y la amilina de ratas. "Encontramos que las diferencias en las estructuras de pramlintida y amilina de rata significan que los iones de cobre impiden la agregación de pramlintida, pero no amilina de rata, "dice Mawadda Alghively, un doctorado estudiante en el equipo de Jaremko.
Los investigadores investigaron el proceso utilizando múltiples técnicas, incluida la resonancia magnética nuclear (en colaboración con Abdul-Hamid Emwas de KAUST CoreLabs), y un ensayo de fluorescencia de "tioflavina T" de agregación de proteínas. Descubrieron que aunque ambos análogos de amilina se unen al cobre, la pramlintida podría unirse de dos formas diferentes debido a un aminoácido histidina de unión al cobre adicional que está presente en la pramlintida pero no en la amilina de rata. La unión de iones de cobre a esta histidina probablemente explicó por qué el cobre redujo la agregación de pramlintida pero no la agregación de amilina de rata. concluyeron los investigadores.
El equipo continúa descifrando la base molecular de la agregación de amilina, Alghbly dice. "Entender cómo se comportan estas moléculas, en última instancia, podría ayudar a facilitar el diseño de nuevos fármacos y terapias eficaces para la diabetes tipo II, " ella dice.