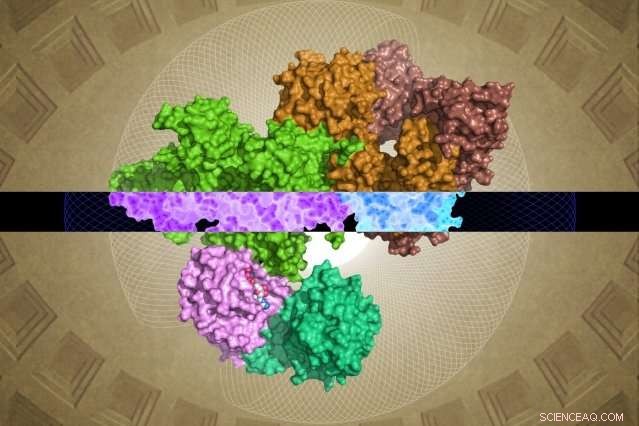
La estructura GATOR1 generada por crio-EM puede proporcionar información sobre su función. Crédito:Steven Lee / Whitehead Institute
Un equipo de investigadores del Instituto Whitehead y el Instituto Médico Howard Hughes ha revelado la estructura de un complejo proteico clave en los seres humanos que transmite señales sobre los niveles de nutrientes. permitiendo que las células alineen su crecimiento con el suministro de materiales necesarios para apoyar ese crecimiento. Este complejo, llamado GATOR1, actúa como una especie de interruptor de encendido y apagado para las señales de "crecer" (o "no crecer") que fluyen a través de una vía de crecimiento celular crítica conocida como mTORC1.
A pesar de su importancia, GATOR1 tiene poca similitud con proteínas conocidas, dejando importantes lagunas en la comprensión de los científicos de su estructura y función molecular. Ahora, como se describe en línea el 28 de marzo en la revista Naturaleza , Los científicos de Whitehead y sus colegas han generado la primera imagen molecular detallada de GATOR1, revelando un grupo de proteínas altamente ordenado y una interacción extremadamente inusual con su socio, la Rag GTPase.
"Si sabe algo sobre la estructura tridimensional de una proteína, entonces puede hacer algunas conjeturas informadas sobre cómo podría funcionar. Pero GATOR1 ha sido básicamente una caja negra, "dice el autor principal David Sabatini, miembro del Whitehead Institute, profesor de biología en el MIT, e investigador del Instituto Médico Howard Hughes (HHMI). "Ahora, por primera vez, hemos generado imágenes de alta resolución de GATOR1 y podemos comenzar a analizar cómo funciona este complejo proteico crítico ".
GATOR1 se identificó por primera vez hace unos cinco años. Consta de tres subunidades de proteínas (Depdc5, Nprl2, y Nprl3), y las mutaciones en estas subunidades se han asociado con enfermedades humanas, incluidos cánceres y afecciones neurológicas como la epilepsia. Sin embargo, debido a la falta de similitud con otras proteínas, la mayor parte del complejo GATOR1 es un misterio molecular. "GATOR1 no tiene dominios proteicos bien definidos, "explica el investigador de Whitehead Kuang Shen, uno de los primeros autores del estudio. "Entonces, este complejo es realmente muy especial y también muy desafiante de estudiar ".
Debido al gran tamaño y la relativa flexibilidad del complejo, GATOR1 no se puede cristalizar fácilmente, un paso necesario para resolver la estructura de la proteína a través del estándar, Métodos cristalográficos de rayos X. Como resultado, Shen y Sabatini se dirigieron a Zhiheng Yu del HHMI. Yu y su equipo se especializan en microscopía crioelectrónica (cryo-EM), una técnica emergente que promete visualizar las estructuras moleculares de proteínas grandes y complejos de proteínas. En tono rimbombante, no utiliza cristales de proteína. En lugar de, las proteínas se congelan rápidamente en una fina capa de hielo vitrificado y luego se obtienen imágenes mediante un haz de electrones rápidos dentro de una columna de microscopio electrónico.
"Ha habido algunos avances importantes en la tecnología cryo-EM durante la última década, y ahora, es posible lograr una resolución atómica o casi atómica para una variedad de proteínas, "explica Yu, un autor principal del artículo y director del HHMI compartió, instalación de crio-EM de última generación en el campus de investigación de Janelia. El Premio Nobel de Química del año pasado fue otorgado a tres científicos por sus esfuerzos pioneros para desarrollar crio-EM.
GATOR1 resultó ser un tema complicado, incluso para cryo-EM, y requirió un poco de prueba y error por parte de Yu, Shen y sus colegas para preparar muestras que pudieran producir información estructural sólida. Es más, El trabajo del equipo se hizo aún más difícil por la forma única del complejo. Sin indicios de la estructura potencial de GATOR1, Shen y sus colegas, incluido el coautor Edward Brignole del MIT, tuvo que derivarlo completamente desde cero.
Sin embargo, El equipo de Whitehead-HHMI pudo resolver estructuras casi completas para GATOR1, así como para GATOR1 unido a sus proteínas asociadas, las GTPasas de trapo. (Dos regiones de la subunidad Depdc5 son muy flexibles y, por lo tanto, no se pudieron resolver). A partir de esta gran cantidad de nueva información, así como de los análisis bioquímicos posteriores del equipo, surgieron algunos hallazgos sorprendentes.
Primero está el notable nivel de organización de GATOR1. La proteína está muy bien organizada, lo cual es bastante inusual para proteínas que no tienen estructuras predichas. (Estas proteínas suelen estar bastante desorganizadas). los investigadores identificaron cuatro dominios de proteínas que nunca antes se habían visualizado. Estos nuevos motivos, llamados NTD, SABA, SHEN, y CTD:podría proporcionar información crucial sobre el funcionamiento interno del complejo GATOR1.
Shen Sabatini, y sus compañeros descubrieron otra sorpresa. A diferencia de otras proteínas que se unen a Rag GTPasas, GATOR1 contacta con estas proteínas en al menos dos sitios distintos. Es más, uno de los sitios de unión sirve para inhibir, en lugar de estimular, la actividad de la Rag GTPasa. "Este tipo de enlace dual nunca se ha observado; es muy inusual, ", Dice Shen. Los investigadores plantean la hipótesis de que esta característica es una de las razones por las que GATOR1 es tan grande, porque debe mantener su Rag GTPase en varios sitios, en lugar de uno, como lo hacen la mayoría de las otras proteínas de este tipo.
A pesar de estas sorpresas, los investigadores reconocen que sus análisis solo han comenzado a arañar la superficie de GATOR1 y los mecanismos a través de los cuales regula la vía de señalización de mTOR.
"Queda mucho por descubrir en esta proteína, "Dice Sabatini.
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.