Crédito:Wiley
La tuberculosis es una de las enfermedades infecciosas potencialmente mortales más extendidas. La resistencia a los antibióticos no solo hace que el tratamiento sea cada vez más difícil, pero la micomembrana relativamente impermeable de la bacteria también limita la eficacia de muchos fármacos. En busca de nuevos antibióticos, Los investigadores han desarrollado un análogo estructural del ácido micólico, el bloque de construcción de la membrana esencial. Como se informó en la revista Angewandte Chemie , este fármaco bloquea las enzimas clave utilizadas en la biosíntesis de micomembranas, aumentando significativamente la eficacia de los antibióticos convencionales.
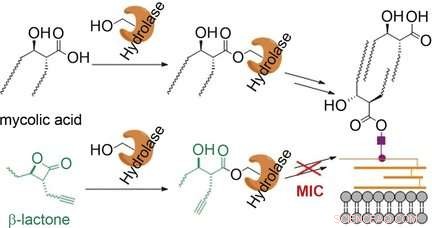
La micomembrana del patógeno de la tuberculosis Mycobacterium tuberculosis es una doble capa de lípidos que forma una barrera externa. Los ácidos micólicos son un componente crítico. Son ácidos grasos β-hidroxilados ramificados con dos largas cadenas de hidrocarburos. La biosíntesis de los ácidos micólicos y su incorporación a la micomembrana implica una serie de pasos enzimáticos críticos en los que las moléculas de ácido micólico se unen a los grupos serina de varias enzimas a través de enlaces éster.
Los científicos que trabajan con Stephan A. Sieber y Eric J. Rubin pensaron que las moléculas camufladas como ácidos micólicos también se unirían a estas enzimas, bloqueándolos e "infiltrando" el proceso de biosíntesis de la membrana. Eligieron probar esta teoría utilizando β-lactonas, anillo tensado de cuatro miembros que contiene un enlace éster interno. La apertura del anillo da como resultado una estructura que corresponde a la parte de las moléculas de ácido micólico que se unen a las enzimas. El equipo de la Universidad Técnica de Munich (Alemania), el Harvard T.H. Escuela de Salud Pública de Chang, Escuela Médica de Harvard, y la Universidad de Texas A&M probaron una amplia gama de diferentes β-lactonas para determinar la actividad antimicobacteriana y dieron en el blanco:el compuesto "EZ120" inhibe la biosíntesis de la micomembrana y elimina las bacterias.
Mediante el uso de pruebas enzimáticas y estudios de espectrometría de masas con sustratos especiales marcados con 13C (perfiles de metabolitos), los científicos demostraron que el nuevo inhibidor bloquea principalmente las enzimas Pks13 y Ag85. Pks13 es una policétido sintasa, que une las dos cadenas de los ácidos micólicos en una sola molécula. Ag85 es un grupo de serina hidrolasas que juega un papel crítico en la incorporación de ácidos micólicos en la micomembrana.
EZ120 funciona en dosis muy pequeñas, es sobresaliente en la entrada de patógenos de la tuberculosis, y tiene baja toxicidad para las células humanas. La administración junto con el antibiótico vancomicina ya autorizado aumenta significativamente la eficacia de ambas sustancias individuales. En combinación con vancomicina, EZ120 es aproximadamente 100 veces más eficaz, presumiblemente porque el debilitamiento de la micomembrana le permite ingresar más fácilmente a las bacterias. Tomado junto con el hecho de que se abordan varios objetivos celulares, esto podría proporcionar un enfoque novedoso para el tratamiento de la tuberculosis.