Investigación publicada recientemente en Comunicaciones de la naturaleza examina las capacidades de una proteína humana que inhibe el VIH-1, APOBEC3G (A3G). El documento destaca el trabajo del profesor y presidente de Física del Noreste Mark Williams, investigador postdoctoral Mike Morse, Profesora Linda Chelico, Universidad de Saskatchewan en Canadá, y Ioulia Rouzina, Universidad del Estado de Ohio. Crédito:Mike Morse / Northeastern University
Hace quince años, se descubrió una clase de proteínas, que dan a los humanos inmunidad innata al VIH-1. Desafortunadamente, El VIH-1 es un virus inteligente y ha evolucionado para combatir estas proteínas. Investigadores del noreste, con la ayuda de sus colaboradores, han estado estudiando estas proteínas durante varios años para ayudar a comprender mejor su función y mecanismos con la esperanza de estar mejor preparados contra el VIH-1.
La investigación, publicado en Comunicaciones de la naturaleza , destaca el trabajo del profesor y presidente de Física del Noreste Mark Williams, investigador postdoctoral Mike Morse, Profesora Linda Chelico, Universidad de Saskatchewan en Canadá, y Ioulia Rouzina, Universidad del Estado de Ohio. El artículo examina las capacidades de una proteína humana que inhibe el VIH-1, APOBEC3G (A3G).
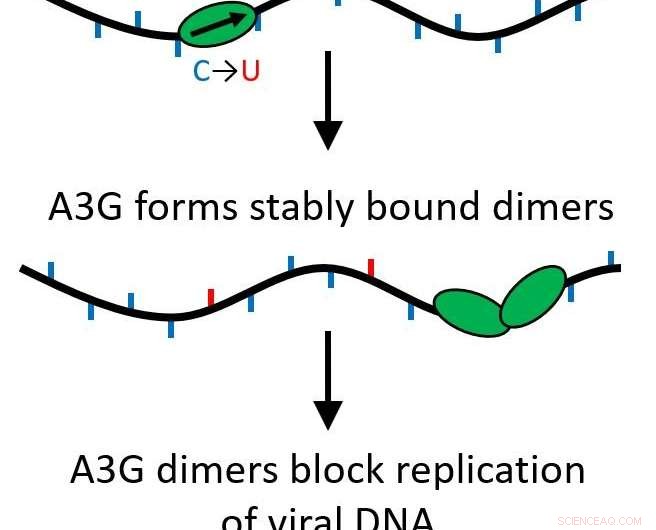
Sus hallazgos determinaron que cuando la proteína A3G crece de una sola proteína (monómero) a un complejo de dos proteínas (dímero), su función pasa de ser una proteína de edición que muta el ADN viral a actuar como un obstáculo para una mayor replicación del virus.
"Me sorprendió por completo el resultado de que los dímeros fueran suficientes para hacer esto, ", dijo Williams." Tenemos nuestros datos, y los datos nos dijeron esto, pero nos tomó mucho tiempo darnos cuenta de que la única forma de entender estos datos es que los dímeros deben ser el modelo para que las propiedades de la proteína cambien repentinamente ".
El Laboratorio Williams de Biofísica de Moléculas Únicas se especializa en instrumentos llamados pinzas ópticas que estudian moléculas como moléculas de ADN individuales o complejos de ADN-proteína. Esta herramienta contiene ADN o ARN entre dos perlas de poliestireno para observar las interacciones con el ADN mediante la observación de cambios en su longitud y tensión. Usando esta técnica, el laboratorio estudia muchos sistemas biológicos diferentes, incluida la replicación del VIH-1. Una combinación de estos métodos biofísicos con los experimentos de actividad enzimática y la creación de formas mutantes de A3G por el laboratorio de Chelico permitió a Williams y Morse comparar la forma original de la proteína con diferentes mutantes que contienen cambios estructurales. Esto permitió el aislamiento del proceso que dio como resultado una proteína dimerizada unida de forma estable.
Durante los últimos 12 años, el laboratorio de Williams ha estado estudiando la replicación del VIH-1 con la ayuda de una subvención del NIH. Su proyecto más reciente implica comprender las proteínas inmunitarias innatas que dan inmunidad a los humanos contra el VIH-1. Hay siete proteínas en la familia APOBEC3, algunos de los cuales luchan contra retrovirus como el VIH-1, mientras que otros luchan contra los retrotransposones, que son elementos genéticos que se amplifican dentro de un genoma y tienen el potencial de causar enfermedades.
Todas las proteínas APOBEC son citidina desaminasas, permitiéndoles modificar el ADN monocatenario para reemplazar las bases, causando mutaciones cuando la hebra se replica. Sin embargo, A3G también tiene otra función que hace todo lo contrario. En lugar de recorrer rápidamente el genoma haciendo modificaciones, puede convertirse en una proteína de unión estable que inhibe el proceso de transcripción inversa, prevenir la replicación del VIH-1. Esto sucede debido a un proceso llamado oligomerización, donde las unidades de proteína única (monómeros) se unen para crear complejos u oligómeros de múltiples proteínas.
"La idea de que podrías acercarte y hacer estos cambios, y, sin embargo, también está bloqueando el movimiento de algo más, realmente no tenía sentido, ", dijo Williams." Es por eso que la oligomerización es tan importante. A medida que comienzan rápido y avanzan, con el tiempo se oligomerizan y se vuelven muy lentos ".
Este equipo de investigadores descubrió la oligomerización según lo publicado en su artículo de 2014 en Química de la naturaleza . Su estudio mostró que el crecimiento de un complejo de múltiples proteínas hizo que la proteína se ralentizara, pero no se sabía cuántas proteínas se necesitaban para formar un complejo lento. Si el número fuera alto, los resultados pueden no ser relevantes para la replicación viral. Además, pudieron demostrar que los complejos eran lentos, pero no pudieron decir si los complejos lentos tenían actividad enzimática. Pero ahora su nueva investigación ha encontrado las respuestas a estas dos preguntas críticas.
"Entre nuestros experimentos en los que observamos directamente la unión de proteínas al ADN, y el trabajo del profesor Chelico que investiga la actividad enzimática de A3G, encontramos que en escalas de tiempo cortas en la forma monomérica, la proteína se une y se disocia muy rápidamente del ADN y tiene una alta actividad enzimática, ", dijo Morse." Pero una vez que dejas que formen estos oligómeros, la encuadernación es mucho más estable, y no se disocia tan fácilmente. El profesor Chelico pudo encontrar que la actividad enzimática en realidad disminuye cuando ocurre este proceso, por lo que tiene estas dos funciones:la actividad enzimática que ocurre en una escala de una sola vez, y en una forma, y esta función secundaria que, debido a la oligomerización, ocurre en otra escala de tiempo ".
Su investigación mostró que esto sucede incluso si solo dos proteínas se unen, formando un dímero. El dímero es suficiente para estabilizar el complejo proteico y alterar la función de la proteína. Dado que solo se necesita un dímero, múltiples obstáculos podrían estar actuando para evitar que se produzca la transcripción inversa. Ahora, es más probable que esta importante función sea biológicamente relevante.
"Saber cómo algo inhibe el VIH-1 podría ser una guía para ayudar a diseñar nuevos métodos para los medicamentos contra el VIH. El virus del VIH-1 ha desarrollado su propia proteína para engañar a la célula para que degrade las proteínas APOBEC, Entonces, si podemos descubrir cómo detener esa degradación, tal vez podamos mejorar la capacidad de esta proteína para inhibir el VIH-1, "Dijo Williams.
El Williams Lab de Northeastern University planea continuar estudiando las diferentes proteínas APOBEC, otros de los cuales inhiben el VIH-1 o los retrotransposones. Mediante el estudio de estas proteínas con sus herramientas únicas de medición biofísica, su laboratorio espera comprender la regulación de las proteínas, actividad, y procesos que nos ayuden a estar más preparados contra el VIH y otras enfermedades relacionadas.