
Una demostración de quiralidad molecular utilizando modelos atómicos 3-D en el laboratorio. Crédito:J. Waser / EPFL
Muchas moléculas químicas pueden existir en la naturaleza junto con sus contrapartes espejo; como manos, dos compuestos pueden estar formados por los mismos átomos en la misma estructura general pero en orientaciones opuestas, es decir, zurdos y diestros. Este fenómeno de simetría se llama "quiralidad", y puede dar contrapartes espejo ("enantiómeros") propiedades químicas completamente diferentes. Un ejemplo famoso y trágico de quiralidad es la talidomida, que se vendió originalmente como una mezcla de ambos enantiómeros. El problema era que uno era un sedante inofensivo y el otro muy tóxico para los fetos. resultando en perturbadoras deformidades congénitas.
Por eso hoy en día se ha vuelto imperativo sintetizar compuestos con lo que se conoce como alta "pureza óptica", que es una medida de pureza quiral:el grado en que una muestra contiene un enantiómero en mayores cantidades que el otro. Pero debido a que los enantiómeros tienen diferencias estructurales muy pequeñas y una estabilidad idéntica, sintetizar uno sobre el otro es una tarea muy desafiante.
Una forma de hacer esto es lo que los químicos llaman "desimetrización" de un compuesto no quiral que es similar a la molécula diana. Se trata de modificar una molécula para que pierda los elementos de simetría que le impedían ser quiral.
Los investigadores del Laboratorio de Catálisis y Síntesis Orgánica de Jérôme Waser en EPFL han desarrollado ahora una nueva estrategia de desimetrización para acceder a bloques de construcción quirales que contienen subestructuras de urea. Los derivados de la urea son componentes importantes de biomoléculas como la biotina (vitamina B7) o los productos naturales bioactivos. como la agelastatina A.
Los investigadores realizaron dos innovaciones cruciales. Primero, diseñaron un precursor de ciclopropano (anillo de carbono de tres miembros) no quiral. Esta molécula ofrece una reactividad mejorada y es ideal para reacciones en condiciones suaves.
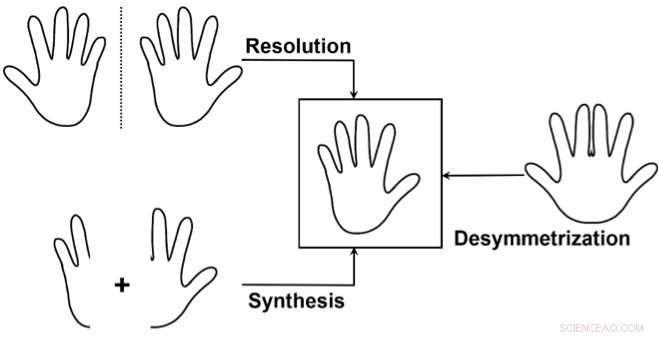
Los tres enfoques principales para acceder a un enantiómero de forma selectiva:1) Separar una mezcla de los dos enantiómeros (resolución), desperdiciando uno de los enantiómeros. 2) Sintetizar selectivamente solo uno de los dos enantiómeros. 3) Utilice una "desimetrización" de un compuesto no quiral similar al objetivo. Esto se usa con menos frecuencia, pero es particularmente elegante ya que puede revelar la quiralidad de un precursor ya relativamente complejo rompiendo la simetría en una sola transformación simple. Crédito:J. Waser / EPFL
Segundo, los investigadores diseñaron un nuevo catalizador de cobre que puede formar un enantiómero del producto deseado con alta selectividad. El centro de cobre se une y activa el precursor del ciclopropano, haciendo que sus lazos se rompan. El precursor luego es atacado por un indol, una molécula muy importante como elemento estructural de compuestos bioactivos. Como resultado, el precursor pierde su simetría - y por lo tanto se vuelve quiral - y puede usarse para producir selectivamente el enantiómero deseado.
El trabajo es un avance importante, ya que la desimetrización nunca antes se ha utilizado para acceder a ureas quirales de ciclopropanos. "Ahora se puede acceder fácilmente a los nuevos bloques de construcción como enantiómeros puros, y puede probarse para determinar su bioactividad o usarse para sintetizar moléculas quirales más complejas, "dice Jérôme Waser." Además, el nuevo catalizador que hemos diseñado sin duda será útil para otras aplicaciones en química sintética ".
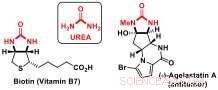
Ureas:bloques de construcción importantes de moléculas bioactivas. Crédito:J. Waser / EPFL