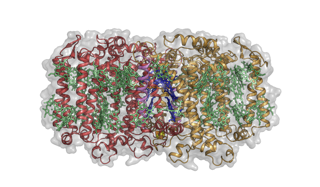
Estructura del centro-fotosistema de reacción fotosintética de Heliobacterium modesticaldum. Crédito:Christopher Gisriel
Un equipo de científicos de la Facultad de Ciencias Moleculares de ASU y de la Universidad Estatal de Pensilvania nos ha acercado un paso más a descubrir los secretos de la fotosíntesis, y posiblemente a combustibles más limpios.
Su descubrimiento se publicó recientemente en línea en Ciencias y describe la estructura de un centro de reacción (de una heliobacteria) que conserva las características del ancestral, y así proporciona una nueva perspectiva sobre la evolución de la fotosíntesis.
La fotosíntesis es el proceso biológico más importante que impulsa la biosfera. Aprovecha la energía de la luz solar, y nos proporciona nuestras principales fuentes de alimento y combustible. El estudio de la fotosíntesis ha permitido a los científicos no solo comprender las complejidades de cómo los organismos usan la luz para impulsar su metabolismo, pero también ha allanado el camino para los avances tecnológicos en fuentes de energía sostenibles.
"El proceso fotosintético se inició hace aproximadamente 3 mil millones de años, antes de que la atmósfera de la Tierra contuviera oxígeno, "dijo Kevin Redding, profesor de la Facultad de Ciencias Moleculares de la Facultad de Artes y Ciencias Liberales, cuyo grupo está liderando la investigación en ASU. "La fotosíntesis funciona mediante el uso de proteínas de membrana especializadas, llamados centros de reacción fotosintética, que recogen la energía de la luz y la utilizan para bombear electrones a través de una membrana biológica de un portador de electrones celular a otro, resultando en la conversión de energía electromagnética (es decir, luz) en energía química, que el organismo puede utilizar ".
Una gran cantidad de investigación ha determinado que estos centros de reacción aparecieron solo una vez en el planeta, y desde entonces se han diversificado para realizar diferentes tipos de química.
A pesar de la diversificación, los centros de reacción conservan la misma arquitectura general, reflejando su origen común. Durante los últimos 3 mil millones de años estas proteínas se han elaborado y cambiado y ha sido difícil reconstruir lo que sucedió durante este enorme período de tiempo. Sin embargo, sabemos que uno de ellos desarrolló la capacidad de oxidar el agua, liberando oxígeno. Esto cambió el mundo irrevocablemente y permitido de por vida como lo conocemos hoy.
El equipo cree que el primer centro de reacción (RC) fue mucho más simple que las versiones que existen hoy. En cuanto a la estructura de la proteína, era un homodímero, es decir, dos copias del mismo polipéptido se juntaron para formar una estructura simétrica. Los centros de reacción cuyas estructuras conocemos son todos heterodímeros en los que se ha roto esta simetría inherente, aunque en el fondo aún conservan los vestigios de la arquitectura simétrica original.
La heliobacteria del artículo en Ciencias es un miembro de la más primitiva de las bacterias fotosintéticas, bacterias que no producen oxígeno; de hecho, son completamente intolerantes al oxígeno, como los primeros organismos. Tampoco pueden fijar el dióxido de carbono de la atmósfera y deben utilizar fuentes de carbono orgánico. Importante para este estudio, su RC es un homodímero.
Por lo tanto, esta es la primera estructura RC homodimérica y arroja luz de varias formas sobre cómo pudo haber sido la RC ancestral. En varios sentidos, la arquitectura general de la proteína es muy similar a los fotosistemas de las plantas y las cianobacterias y al RC de las bacterias de azufre púrpura. Sin embargo, construidas sobre esa arquitectura común hay algunas diferencias químicas cruciales que dan como resultado una química diferente a la de los RC conocidos, incluida su capacidad para usar vehículos solubles en agua y liposolubles, una capacidad que antes se pensaba que estaba restringida a uno u otro tipo de RC.
Este trabajo es el resultado de una colaboración entre Kevin Redding, Raimund Fromme, profesor asociado de investigación en la Facultad de Ciencias Moleculares e investigador del Centro de Biología Estructural Aplicada del Instituto Biodesign, y John Golbeck de la Universidad Estatal de Pensilvania.
Redding y Golbeck habían decidido hace 8 años unir fuerzas para abordar la RC heliobacteriana. Combinaron sus subvenciones individuales del Departamento de Energía en una subvención conjunta, que desde entonces se ha renovado dos veces:la tercera iteración comenzó hace un año. Fromme se unió oficialmente al grupo hace unos 4 años, aunque había estado trabajando previamente en cristalografía del RC con Iosifina Sarrou, becario postdoctoral en el grupo Redding que había optimizado su depuración. El trabajo realmente despegó cuando Christopher Gisriel, estudiante de doctorado en el grupo Redding, Empecé a trabajar con Fromme para cristalizar el RC.
"Le doy el crédito a Chris y Raimund por hacer lo necesario para conseguir esta estructura, "dijo Redding, quien también es el director del Centro de Bioenergía y Fotosíntesis de ASU.
"La experiencia de Raimund en la cristalización de proteínas de membrana y la solución de su estructura fue crucial. Chris hizo el arduo trabajo de mejorar la purificación, optimizar las condiciones de cristalización, y llevando sus cristales a las líneas de luz en numerosas ocasiones. Y debido a que la proteína es inherentemente sensible al oxígeno, ¡tuvo que hacer toda la purificación y cristalización en una guantera! "
"Este es el momento que espera un cristalógrafo, "dijo Fromme, explicando los años que puede llevar desarrollar el cristal de proteína perfecto adecuado para estudios de rayos X.
Redding continuó, "Pudieron obtener la calidad de difracción de una resolución de ~ 10 Å a 2-2,5 Å en unos pocos años de arduo trabajo ... y luego vino la hercúlea tarea de resolver la estructura. Chris comenzó con un modelo muy sencillo de cómo se vería el RC, basado en similitudes esperadas con el Fotosistema I de cianobacterias, y luego trabajé constantemente en él durante meses. Tuvo que aprender por sí mismo nuevo software y trabajar largas noches para llegar allí. Una vez que tuvo algo que parecía real, Raimund pudo tomar eso y llevarlo al siguiente nivel. Y trabajando juntos han producido una estructura realmente hermosa con una resolución muy alta ".
"Chris es un veterano del ejército de los EE. UU., habiendo servido en Afganistán, "Dijo Redding." Llegó a ASU como un estudiante de bioquímica y comenzó a trabajar en mi laboratorio como investigador de pregrado. Nunca antes había considerado seriamente la posibilidad de una carrera en investigación, al principio no estaba seguro de hasta dónde quería llegar por este camino. Sin embargo, pronto desarrolló un gusto por ella, y luego me presionó para que le permitiera asumir el proyecto de cristalografía RC como estudiante de maestría. Le advertí que no lo hiciera, sabiendo lo difícil que sería y las pocas posibilidades de éxito, pero persistió, y finalmente cedí. Más tarde decidió seguir un doctorado. Él defenderá su disertación a finales de este semestre y no podría estar más orgulloso de él ".
"Este centro de reacción solo se encuentra en organismos que pueden vivir en ambientes libres de oxígeno, como el de la Tierra primitiva, ", Dijo Gisriel." Este trabajo ha abierto la puerta para que los científicos de todo el mundo comparen las características del centro de reacción primitivo con las de los centros de reacción más avanzados que residen en organismos tolerantes al oxígeno. Como resultado, estamos obteniendo una imagen más clara e informada de cómo la naturaleza optimizó la recolección de energía impulsada por la luz ".