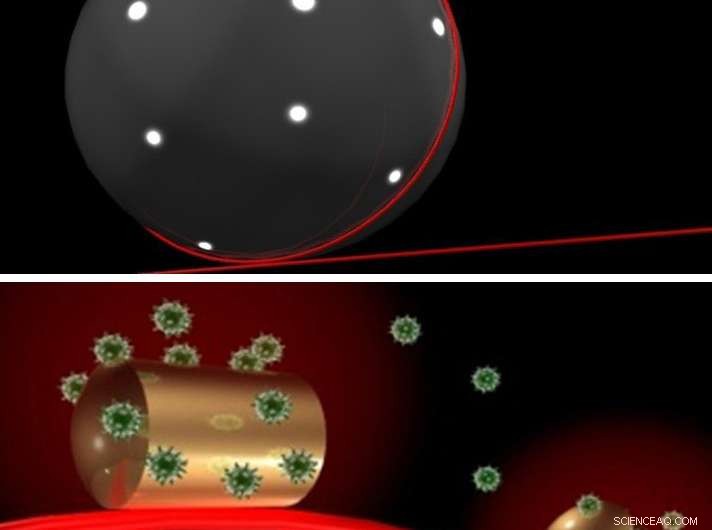
Un sensor en un sensor:la luz láser (roja) se ilumina (arriba) en una microperla de vidrio a la que se fija una nanovarilla de oro. La luz láser recorre el interior de la microperla y se concentra en la varilla de oro, a las que se pueden unir biomoléculas (en este caso proteínas) (abajo). Cuando la molécula se mueve, cambiando la medida en que se superpone con el campo de luz, el sensor produce una señal. Esto permite observar las enzimas y los movimientos de las enzimas sin utilizar un marcador. Crédito:Frank Vollmer / Science Advances
Investigadores del Instituto Max Planck para la Ciencia de la Luz en Erlangen han desarrollado una técnica para observar directamente cómo las enzimas y otras biomoléculas realizan su trabajo. con beneficios médicos y científicos potencialmente significativos. Usando esta técnica, ellos tienen, por primera vez con solo luz y sin rotulador, cambios conformacionales observados en la ADN polimerasa, la enzima responsable de replicar el ADN. Debido a que la técnica también se puede utilizar para estudiar cómo las enzimas realizan su trabajo, podría ayudar a identificar nuevos mecanismos para el desarrollo de fármacos.
Cuando los biólogos miran a través de un microscopio moderno, lo que ven se parece un poco a lo que podría ver si mirara a lo largo de una carretera de noche:los vehículos solo son visibles por sus faros y es imposible saber si los faros pertenecen a un automóvil o un camión, o si un automóvil estacionado está abriendo la puerta. En el presente, Los biólogos solo pueden observar las enzimas que realizan su trabajo de manera indirecta. Adhieren tintes fluorescentes a componentes individuales de biomoléculas y luego observan los puntos de luz que se mueven bajo un microscopio. Pueden ver muy poco de cómo está cambiando la forma de la enzima. Además, tener una molécula de tinte adherida significa que la enzima que están observando no está en su estado natural. No se puede descartar que tales moléculas de colorante puedan afectar la función de la enzima.
Un equipo de investigadores encabezado por Frank Vollmer, hasta hace poco, líder de un grupo de investigación en el Instituto Max Planck para la Ciencia de la Luz y ahora profesor en la Universidad de Exeter, tiene, sin embargo, desarrollaron una técnica que les permitía observar las enzimas sin colocar un marcador fluorescente.
Una nanovarilla concentra la luz en un área de unos pocos nanómetros
Su instrumento microscópicamente pequeño es efectivamente un sensor en un sensor. Una nanovarilla de oro de alrededor de 10 nanómetros de diámetro y 40 nanómetros de largo se une a una microperla de vidrio con un diámetro de aproximadamente 80 micrómetros (1 micrómetro =1/1000 milímetro). Una onda de luz producido por un láser, se envía deslizándose alrededor del borde interior de esta microperla. Debido a que esta onda se superpone muy ligeramente al borde de la microperla, interactúa con la nanovarilla adjunta.

Una mano:el sensor es capaz de detectar cuándo una molécula de ADN polimerasa se une a la nanovarilla de oro de un nanosensor plasmónico y sintetiza una hebra de ADN. Durante este proceso, la enzima se abre y se cierra como una mano, cambiando la medida en que se superpone con el punto de luz en la nanovarilla de oro. Esto cambia la longitud de onda de la luz que se acerca al interior de la microperla. Los investigadores utilizan este cambio en la longitud de onda como una medida del grado de superposición. Crédito:Frank Vollmer / Science Advances
Esta interacción comienza bastante débil, pero la microperla actúa como una galería susurrante:en una rotonda, una palabra susurrada a lo largo de la pared se puede escuchar claramente al otro lado, porque la onda de sonido sigue la curva de la pared en lugar de dispersarse en todas direcciones. Del mismo modo, la onda de luz que da vueltas y vueltas por el interior de la microperla pasa la nanovarilla de oro miles de veces en un espacio de tiempo extremadamente corto, amplificando la interacción con la nanovarilla.
La nanovarilla extrae la luz que se superpone aún más al borde de la microperla. El resultado es un área concentrada de luz como un foco de aproximadamente el mismo tamaño que la barra, es decir, solo unos pocos nanómetros de diámetro. Si una enzima u otra molécula se une a la nanovarilla de oro, está bañado por este foco de luz. La señal que produce el sensor depende de la molécula colocada en el foco y cómo se mueve dentro de esta luz. Esto permite a los investigadores investigar y registrar los movimientos de una sola molécula de enzima.
Diferentes señales para diferentes conformaciones enzimáticas.
La técnica se basa en un fenómeno conocido como plasmónicos. Aplicado a pequeñas estructuras metálicas como nanobarras, La plasmónica permite que la luz se concentre en un área de unos pocos nanómetros. "Esto nos permite reducir la luz al tamaño de una enzima, ", explica Frank Vollmer del Instituto Max Planck para la Ciencia de la Luz en Erlangen. Y aún más, los investigadores de Erlangen incluso han logrado utilizar su técnica para sondear iones individuales.
En un experimento, los físicos conectaron la enzima ADN polimerasa a su sensor y luego trataron de registrar cómo se mueve. La ADN polimerasa se asemeja a una mano que sujeta una tubería; en este caso, la tubería es la hebra de ADN que está procesando. Esta "mano" produce una señal diferente cuando está abierta y cuando está cerrada, ya que esto cambia el tamaño de la superposición entre el punto de luz y la enzima. Esto ha permitido a los investigadores registrar cómo se abre y se cierra la enzima en tiempo real. "Un mayor refinamiento de nuestra técnica debería permitirnos hacer cosas como registrar directamente la síntesis de una cadena de ADN por la enzima polimerasa, ", explica Vollmer. Los bioquímicos podrían observar en tiempo real cómo la enzima copia la información genética e incluso utilizar la señal producida por el nanosensor para la secuenciación del ADN.

Detección de iones individuales:el sensor es tan sensible que la señal incluso se muestra cuando un solo ion se une a la punta de la nanovarilla (que se muestra aquí en forma esquemática) adherida a la microperla de vidrio. Crédito:Frank Vollmer / Nature Photonics
Los experimentos que utilizan la nueva técnica han podido observar más que cómo se mueven las enzimas. "Lo hemos utilizado para observar la dependencia de la temperatura de la actividad enzimática, "explica Frank Vollmer. Esto ofrece una forma sencilla de realizar estudios termodinámicos. Estos estudios pueden proporcionar información sobre características como la energía de activación de una enzima, explica el físico. La energía de activación es una medida de la eficiencia de estos catalizadores biológicos.
El nanosensor se puede utilizar para observar reacciones químicas.
Para demostrar cuán pequeñas pueden ser las partículas que se pueden detectar con un nanosensor plasmónico, los investigadores lo utilizaron para observar iones individuales (átomos cargados eléctricamente). "Nos sorprendió que esto fuera posible, ", dice Vollmer. Los iones de zinc y mercurio que utilizaron tienen un tamaño de solo una décima parte de un nanómetro, menos de una milésima de la longitud de onda de la luz utilizada. sin embargo, posible producir un punto de luz al final de una nanovarilla que es capaz de sondear dimensiones tan pequeñas. "No se trata de identificar iones individuales, "enfatiza Vollmer. Los investigadores pudieron asegurar que exactamente un ion se uniera al final de la nanovarilla variando la concentración de iones en la solución. Bajar a esta escala podría permitir a los biólogos estudiar la función de los canales de iones. Los canales de iones incluyen, por ejemplo, proteínas incrustadas en las membranas de las células nerviosas que son responsables de la transmisión de señales a lo largo del nervio.
El uso del nanosensor desarrollado por el equipo de Frank Vollmer no se limita a visualizar procesos bioquímicos que involucran enzimas y otras proteínas. También se puede utilizar para observar reacciones químicas entre moléculas individuales y la superficie de la nanovarilla de oro. "Con esta técnica, podemos, por ejemplo, detectar y analizar mecanismos de interacción, "explica Frank Vollmer. El curso temporal de estas interacciones puede proporcionar información sobre cómo las diferentes moléculas se unen a la superficie de la nanovarilla de oro.
Para demostrar esto, los investigadores estudiaron dos tipos de moléculas, uno que contiene un grupo amina, uno que contiene un grupo tiol. "Resulta que los dos grupos reaccionan con la superficie del oro a través de diferentes mecanismos, "explica Vollmer. Mientras que los grupos amina se unen a átomos de oro que se proyectan desde la superficie, los grupos tiol solo se unen a átomos incrustados completamente en la superficie.

Moléculas exigentes:las moléculas con grupos amino (rosa) se adhieren a los átomos de oro que se proyectan desde la superficie de la nanovarilla. Por el contrario, Las moléculas con grupos tiol (azul) se adhieren a los átomos de oro incrustados en la superficie. Si las moléculas adsorbidas reaccionan entre sí depende de tener las condiciones de reacción adecuadas, (específicamente pH, fuerza iónica y temperatura). Debido a que la reacción es visible en la señal del sensor, el nanosensor plasmónico se puede utilizar para optimizar rápidamente las reacciones de superficie. Crédito:Frank Vollmer / Materiales avanzados
Los investigadores también observaron reacciones entre las diversas moléculas. "Esto permite a los químicos probar y optimizar las condiciones de reacción en tiempo real, ", dice Vollmer. El uso de este punto de luz de nanovarillas de oro no se limita al estudio de reacciones químicas, sin embargo, también se puede utilizar para controlarlos. Al aumentar la intensidad de la luz en el punto de luz concentrado, los investigadores permitieron que un ion de mercurio se uniera a la superficie de la nanovarilla de oro. La intensidad de la luz en el punto de luz aumenta la energía de los electrones en la barra de oro para que puedan reaccionar con los iones de mercurio. Esto produce una amalgama estable de oro y mercurio. Los dos elementos permanecen fusionados incluso cuando desaparece el punto de luz, ya que la reacción produce un enlace covalente relativamente estable entre un átomo de oro y un átomo de mercurio.
"El control de las reacciones y la actividad enzimática en el biosensor plasmónico es un área muy interesante para futuras investigaciones, ", dice Vollmer. El punto de luz también se puede utilizar como pinzas ópticas para fijar temporalmente biomoléculas individuales al sensor para el análisis óptico.
Información sobre el mal funcionamiento de la maquinaria de la vida.
La visión futura del equipo de Vollmer es poder escanear moléculas, tanto biomoléculas como moléculas sintéticas, átomo por átomo. "Al utilizar diferentes fuentes de luz con diferentes longitudes de onda y polarizaciones, En principio, es posible modificar el grado en que la luz se superpone a la molécula y sondear diferentes dominios de la misma molécula, "explica Vollmer. Un escáner molecular de este tipo podría ser capaz de observar un proceso desde una variedad de ángulos diferentes y en intervalos muy cortos. Un mapa de alta resolución de tal proceso mejoraría significativamente nuestra comprensión de la maquinaria molecular. Los biólogos incluso poder observar en detalle cómo tales estructuras cambian en periodos que van desde nanosegundos hasta varias horas. El biosensor plasmónico también plantea la posibilidad de un laboratorio automatizado del tamaño de una uña, que escanea una muestra, proteína por proteína, para diagnosticar enfermedades a nivel molecular.
Si en el futuro fuera posible utilizar nanosensores plasmónicos para ver cómo las enzimas cambian de forma, Esto podría permitir a los médicos comprender mejor cómo el mal funcionamiento de la maquinaria de la vida causa enfermedades como el Alzheimer, que están asociados con cambios en la estructura enzimática. Una mejor comprensión de estos procesos incluso podría proporcionar nuevos enfoques de tratamiento.