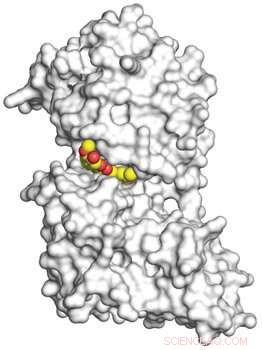
Una imagen en 3D, obtenido mediante cristalografía de rayos X, muestra la curcumina en amarillo y rojo que se une a la enzima quinasa quinasa 2 regulada por tirosina de especificidad dual (DYRK2) en blanco a nivel atómico. Crédito:UC San Diego Health
Mediante cristalografía de rayos X y perfiles de especificidad de inhibidores de cinasas, Investigadores de la Facultad de Medicina de la Universidad de California en San Diego, en colaboración con investigadores de la Universidad de Pekín y la Universidad de Zhejiang, revela esa curcumina, un compuesto químico natural que se encuentra en la especia de la cúrcuma, se une a la enzima quinasa quinasa 2 regulada por tirosina de especificidad dual (DYRK2) a nivel atómico. Esta interacción bioquímica de la curcumina no informada anteriormente conduce a la inhibición de DYRK2 que altera la proliferación celular y reduce la carga del cáncer.
Pero antes de recurrir a la curcumina o los suplementos de cúrcuma, Sourav Banerjee, Doctor., Becario postdoctoral de la Facultad de Medicina de UC San Diego, advierte que la curcumina por sí sola puede no ser la respuesta.
"En general, la curcumina se expulsa del cuerpo bastante rápido, ", dijo Banerjee." Para que la curcumina sea una droga eficaz, necesita ser modificado para ingresar al torrente sanguíneo y permanecer en el cuerpo el tiempo suficiente para atacar el cáncer. Debido a varios inconvenientes químicos, la curcumina por sí sola puede no ser suficiente para revertir por completo el cáncer en pacientes humanos ".
Escribiendo en la edición del 9 de julio de la procedimientos de la Academia Nacional de Ciencias , Banerjee y sus colegas informan que la curcumina se une e inhibe a DYRK2, lo que conduce al impedimento del proteasoma, la maquinaria de proteína celular que destruye las proteínas innecesarias o dañadas en las células, lo que a su vez reduce el cáncer en ratones.
"Aunque la curcumina se ha estudiado durante más de 250 años y sus propiedades anticancerígenas se han informado anteriormente, ningún otro grupo ha informado de una estructura cocristalina de curcumina unida a un objetivo de proteína quinasa hasta ahora, "dijo Banerjee, primer autor del estudio. "Debido a su trabajo en la cristalografía, nuestros colaboradores en la Universidad de Pekín, Chenggong Ji y Junyu Xiao, nos ayudó a visualizar la interacción entre la curcumina y DYRK2 ".
"Se pensaba que las enzimas quinasas IKK y GSK3 eran los principales objetivos de la curcumina que conducen al efecto anticanceroso, pero la estructura cocristalina de la curcumina con DYRK2 junto con un perfil de inhibidor de quinasa de 140 paneles revelan que la curcumina se une fuertemente al activo sitio de DYRK2, inhibiéndolo a un nivel 500 veces más potente que IKK o GSK3 ".
Trabajando junto a Jack E. Dixon, Doctor., Profesor Distinguido de Farmacología, Medicina Celular y Molecular, Química y Bioquímica en UC San Diego, Banerjee y su equipo han estado buscando reguladores de proteasomas para inhibir la formación de tumores por cánceres adictos a proteasomas como el cáncer de mama triple negativo (TNBC) y la neoplasia maligna de células plasmáticas llamada mieloma múltiple.
Usando bioquímicos, En modelos de cáncer de ratón y modelos celulares, el equipo descubrió que la curcumina es un inhibidor selectivo de DYRK2 y que esta nueva diana molecular tiene un potencial anticanceroso prometedor no solo para cánceres quimiosensibles sino también resistentes / adaptados a inhibidores de proteasoma.
"Nuestros resultados revelan un papel inesperado de la curcumina en la inhibición del proteasoma DYRK2 y proporcionan una prueba de concepto de que la manipulación farmacológica de los reguladores del proteasoma puede ofrecer nuevas oportunidades para el tratamiento del mieloma múltiple y el cáncer de mama triple negativo difícil de tratar, "dijo Dixon, quien fue coautor principal de Xing Guo de la Universidad de Zhejiang, Doctor., en el papel. "Nuestro objetivo principal es desarrollar un compuesto químico que pueda dirigirse a DYRK2 en pacientes con estos cánceres".
El agotamiento de DYRK2 altera la actividad del proteasoma y exhibe tasas de proliferación de cáncer más lentas y una carga tumoral significativamente reducida en modelos de ratón. En combinación con el medicamento para el mieloma múltiple aprobado por la FDA, carfilzomib, la curcumina indujo una muerte mucho mayor de las células cancerosas, mientras que las células normales no cancerosas se vieron menos afectadas. Esto sugiere que dirigirse a los reguladores del proteasoma (como DYRK2) en combinación con inhibidores del proteasoma puede ser un enfoque prometedor de la terapia contra el cáncer con menos efectos secundarios, pero se necesita más trabajo. dijo Banerjee.