Crédito:Katsutoshi Nagaoka
(Phys.org) —El hidrógeno tiene el potencial de proporcionar una alternativa, fuente de energía limpia, particularmente cuando se aplica a la tecnología de pilas de combustible. Las fuentes de combustible actuales incluyen combustibles fósiles que contienen carbono o moléculas orgánicas que contienen carbono, que resultan en la producción de exceso de CO 2 , un gas de efecto invernadero. Varias iniciativas, incluida una iniciativa nacional en Japón, tratar de crear una sociedad de uso bajo en carbono mediante el uso de fuentes alternativas de combustible.
La iniciativa Energy Carriers en Japón es un proyecto nacional que busca específicamente formas de almacenar y transportar hidrógeno de manera eficiente. Una forma de hacerlo es utilizar amoníaco como fuente de hidrógeno. Sin embargo, el descubrimiento de un proceso eficiente para descomponer el amoníaco ha resultado difícil, en gran parte porque el proceso catalítico para descomponer el amoníaco requiere la adición continua de calor, que puede ser prohibitivamente caro.
Katsutoshi Nagaoka, Takaaki Eboshi, Yuma Takeishi, Ryo Tasaki, Kyoto Honda, Kazuya Imamura, y Katsutoshi Sato de la Universidad de Oita en Japón han desarrollado un método que utiliza un catalizador novedoso para producir hidrógeno a partir de amoníaco sin la adición de calor externo a través del ciclo catalítico. Su trabajo aparece en Avances de la ciencia .
La descomposición del amoníaco en hidrógeno y nitrógeno es un proceso endotérmico, lo que significa que requiere la adición de energía para obtener productos. Esto significa que las reacciones de descomposición catalítica tradicionales requieren la adición de una gran cantidad de calor para obtener una cantidad útil de gas hidrógeno.
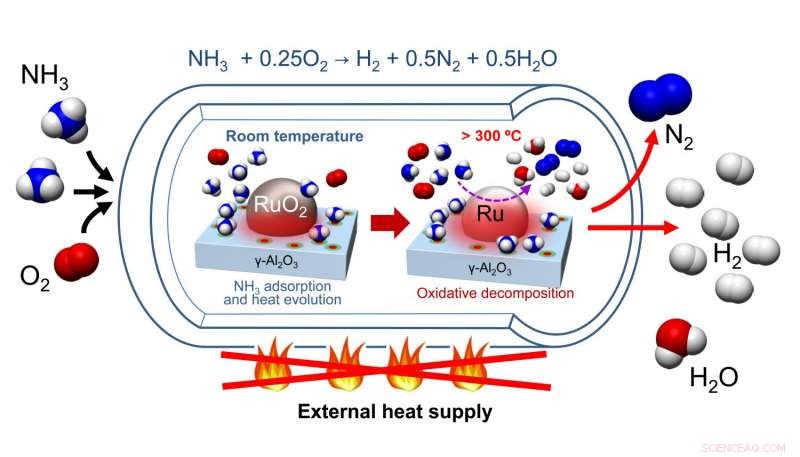
Nagaoka y col. desarrolló un catalizador que está hecho de un RuO 2 nanopartícula soportada en γ-Al 2 O 3 lecho de catalizador. Después de purgar su catalizador de H 2 O y CO 2 , Se agregaron amoníaco y oxígeno al recipiente de reacción donde se adsorbió amoníaco en la superficie catalítica, resultando en un aumento de temperatura. Este aumento de temperatura catalizó la descomposición oxidativa del amoníaco, un proceso exotérmico. Esto calentó la reacción, que a su vez, proporcionó la energía para la descomposición endotérmica del amoníaco en hidrógeno y nitrógeno.
El pretratamiento del catalizador requirió calentamiento para eliminar el agua y el dióxido de carbono, pero no requirió recalentamiento posterior. Las pruebas sobre el ciclo del catalizador mostraron que después del pretratamiento inicial del RuO 2 / γ-Al 2 O 3 catalizador con helio a 300 o C, el catalizador pudo realizar tres ciclos y aún producir hidrógeno con rendimientos máximos. Es más, Estos estudios incluyeron pasivación oxidativa para garantizar que no se produjera calor a partir de la oxidación de Ru a RuO. 2 . En la práctica, No será necesaria la pasivación oxidativa. Entonces, aunque se requiere calentamiento para pretratar el catalizador, no se requiere calentamiento para ciclos adicionales del catalizador.
En un esfuerzo por comprender cómo el RuO 2 / γ-Al 2 O 3 el catalizador funciona, Nagaoka y col. comparó la temperatura máxima del lecho catalítico que resulta del autocalentamiento de RuO 2 / γ-Al 2 O 3 a RuO 2 /La 2 O 3 , un catalizador de descomposición de amoniaco conocido. Descubrieron que el catalizador a base de aluminio calentado a una temperatura máxima de 97 o C, mientras que el catalizador a base de lantano se calentó a una temperatura máxima de 53 o C.Esto es importante porque la temperatura de autoignición para la combustión oxidativa del amoníaco es de 90ºC. o C, y explica por qué se observaron mejores rendimientos de reacción con RuO 2 / γ-Al 2 O 3 .
Los autores señalan que esta diferencia en la temperatura de adsorción probablemente se deba a la interacción favorable entre el amoníaco, una molécula básica, y Al 2 O 3 , que es un ácido de Lewis. La 2 O 3 , por otra parte, es una base de Lewis.
Adicionalmente, los autores observaron la diferencia entre usar γ-Al desnudo 2 O 3 como catalizador y RuO 2 / γ-Al 2 O 3 . Descubrieron que el 90% del amoníaco se adsorbe en el γ-Al2O3 desnudo en comparación con el lecho del catalizador y el RuO 2 nanopartícula. Esto implica que el amoníaco se quimisorbe en la nanopartícula y el γ-Al 2 O 3 , que luego promueve la fisisorción multicapa.
En general, este tipo de catalizador es útil para proporcionar suficiente calor para superar los requisitos de calor necesarios para la descomposición endotérmica del amoníaco en hidrógeno y nitrógeno gaseoso. Este estudio muestra que la catálisis de autocalentamiento es una opción viable para explorar soluciones a las dificultades prácticas en el uso de amoníaco como fuente de combustible de hidrógeno.
© 2017 Phys.org