Estructura del receptor suavizado humano multidominio, un importante objetivo farmacológico para el cáncer. Crédito:Universidad ShanghaiTech
Un equipo de científicos dirigido por el Instituto iHuman de la Universidad ShanghaiTech en colaboración con la Universidad Fudan ha determinado la estructura cristalina de alta resolución del receptor suavizado humano multidominio. Los resultados ilustran las interacciones dominio-dominio alostérico dentro del receptor, y su papel en la activación suavizada. Estos nuevos hallazgos se publican el 17 de mayo de 2017 en Comunicaciones de la naturaleza , titulado "Estructura cristalina de un receptor suavizado humano multidominio en un complejo con un ligando superestabilizador, "por Zhang X-J et al.
Como actor central en la vía de señalización Hedgehog involucrada en el desarrollo embrionario y la tumorigénesis, el receptor suavizado (SMO) ha sido buscado durante mucho tiempo como objetivo farmacológico para numerosos cánceres. Sin embargo, la resistencia a los medicamentos ha sido un problema debido a mutaciones en SMO. "El desarrollo de fármacos anti-SMO de próxima generación se facilitará mediante la comprensión de la disposición multidominio en la estructura SMO", dijo Fei Xu, Profesor asistente en iHuman Institute, Universidad ShanghaiTech, y el autor principal correspondiente de este artículo. "Esta estructura nos permitirá identificar potencialmente nuevos sitios de unión de ligandos y mecanismos de señalización".
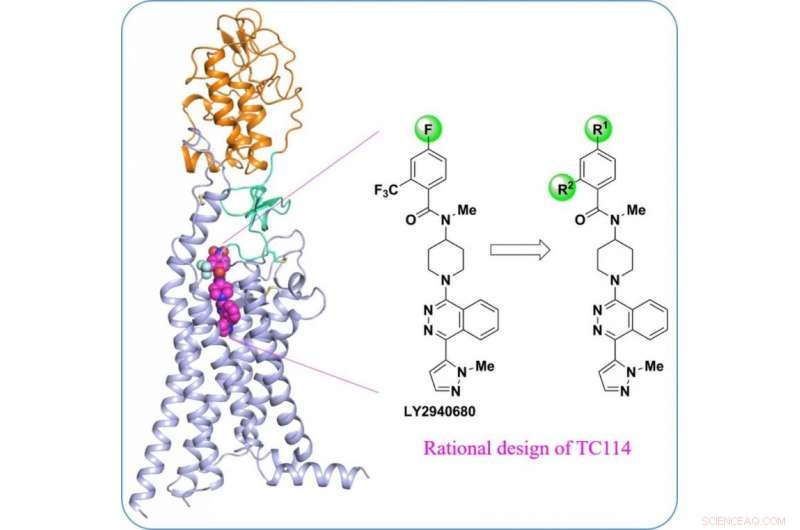
"Para estabilizar la proteína SMO humana multidominio, diseñamos una serie de compuestos químicos para herramientas ", dijo Houchao Tao, Profesor asociado de investigación en iHuman Institute. "TC114 es una sonda que estabiliza y bloquea significativamente el receptor en una única conformación". Con una mayor optimización, El estudiante de doctorado Xianjun Zhang resolvió la estructura SMO multidominio unida a TC114 a 2,9 angstrom utilizando un láser de rayos X de electrones libres. "Esta estructura revela el dominio de bisagra que puede desempeñar importantes funciones de modulación en la conexión de los dominios, proporcionando pistas para el desarrollo de nuevos moduladores dirigidos a esta región ", dijo Xianjun Zhang.
"Este es un hermoso trabajo en equipo", dijo Raymond Stevens, Director del Instituto iHuman, Universidad ShanghaiTech, "La química y la biología están unidas en esta ciencia para comprender la estructura y función de este complejo receptor de múltiples dominios. La estructura cristalina, Sucesivamente, abre nuevas vías para el descubrimiento de fármacos ".