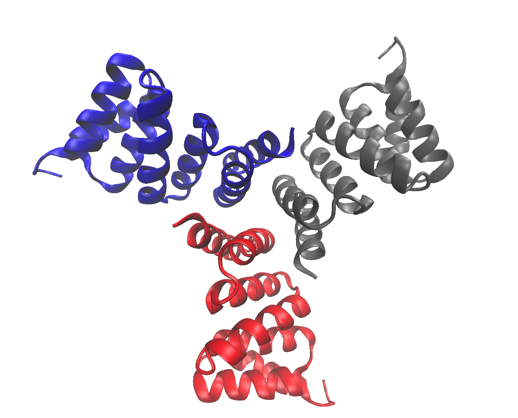
La estructura cristalina de alta resolución de una de las proteínas estudiadas, un trímero diseñado computacionalmente. La estructura se ha depositado en el Protein Data Bank con el número de acceso 5HRZ. Crédito:Laboratorio Nacional Lawrence Berkeley
Las proteínas cíclicas que se ensamblan a partir de múltiples subunidades idénticas (homo-oligómeros) juegan un papel clave en muchos procesos biológicos, incluyendo la señalización celular y la catálisis enzimática y la función de las proteínas. Investigadores de la División de Biofísica Molecular y Bioimagen Integrada (MBIB) de Berkeley Lab trabajaron con David Baker de la Universidad de Washington, quien dirigió un equipo para diseñar in silico y cristalizar proteínas homo-oligoméricas cíclicas autoensambladas.
Al predecir y diseñar estos oligómeros de orden superior, Baker y su equipo han logrado comprender los principios fundamentales que subyacen a las interacciones oligómero-oligómero. Más allá de las interacciones internas de la propia proteína, Estos oligómeros diseñados se pueden usar para explorar preguntas básicas sobre cómo la estructura de las moléculas de señalización afecta el comportamiento de los receptores y la respuesta celular.
Se desarrolló una estrategia para diseñar interfaces en proteínas idealizadas destinadas a dirigir su ensamblaje en complejos multiméricos. Los investigadores de Berkeley Lab utilizaron la caracterización estructural, tanto cristalografía de rayos X como dispersión de rayos X de ángulo pequeño (SAXS), para mostrar que muchos de los diseños adoptaron el estado de oligomerización objetivo y la estructura predicha. Su trabajo no solo demuestra que los científicos tienen una comprensión básica de lo que determina la oligomerización, también muestra que pueden diseñar proteínas con forma sintonizable, Talla, y simetría para una variedad de aplicaciones biológicas.
Parte del trabajo de cristalografía de rayos X incluido en el artículo se realizó bajo los auspicios del programa Colectivo de Cristalografía, que está dirigido por el científico investigador Banumathi Sankaran en Advanced Light Source. El científico investigador Henrique Pereira cristalizó las proteínas diseñadas por los investigadores de la Universidad de Washington. Sankaran y Peter Zwart, Científico del personal de MBIB, recopiló datos cristalográficos sobre Beamline 5.0.2 en el Centro de Biología Estructural de Berkeley y resolvió las estructuras. Para obtener información sobre la dinámica de las proteínas diseñadas, Kathryn Burnett y Greg Hura de MBIB realizaron SAXS en la línea de luz SIBYLS.
Pereira, Sankaran, y Zwart han sido coautores de varios artículos con Baker y su equipo, todo lo cual sigue un tema de diseño de proteínas y validación de estructura.
"Los homooligómeros cíclicos juegan un papel importante en la función biológica, ", dijo Sankaran." Aquí tenemos otro diseño sintético que se ha demostrado que coincide con el diseño computacional con estudios de solución de ángulo pequeño y dispersión de rayos X ".
Este trabajo, junto con la hoja beta curva y los diseños de metaloproteínas triméricas, ampliar las posibilidades de desarrollo de nuevas terapias y biomateriales.