El comienzo de la vida en la Tierra y su evolución a lo largo de miles de millones de años siguen intrigando a los investigadores de todo el mundo. El dogma central o el flujo direccional de información genética desde una plantilla de ácido nucleico de desoxirribosa (ADN) a una transcripción de ácido nucleico de ribosa (ARN) y, finalmente, a una proteína funcional, es fundamental para la estructura y las funciones celulares.
El ADN funciona como modelo de la célula y transporta la información genética necesaria para la síntesis de proteínas funcionales. Por el contrario, las proteínas son necesarias para la síntesis de ADN. Por lo tanto, sigue siendo un tema de debate si surgió primero el ADN o la proteína.
Esta versión molecular de la cuestión del "huevo y la gallina" condujo a la propuesta de un "Mundo de ARN". Los ARN en forma de "ribozimas" o enzimas de ARN transportan información genética similar al ADN y también poseen funciones catalíticas como las proteínas.
El descubrimiento de las ribozimas impulsó aún más la hipótesis del mundo del ARN en la que el ARN cumplía funciones duales de "almacenamiento de información genética" y "catálisis", facilitando las actividades de la vida primitiva únicamente mediante el ARN. Si bien los ribosomas modernos son un complejo de ARN y proteínas, las ribozimas durante las primeras etapas evolutivas pueden haberse reconstruido mediante el ensamblaje de unidades de ARN funcionales individuales.
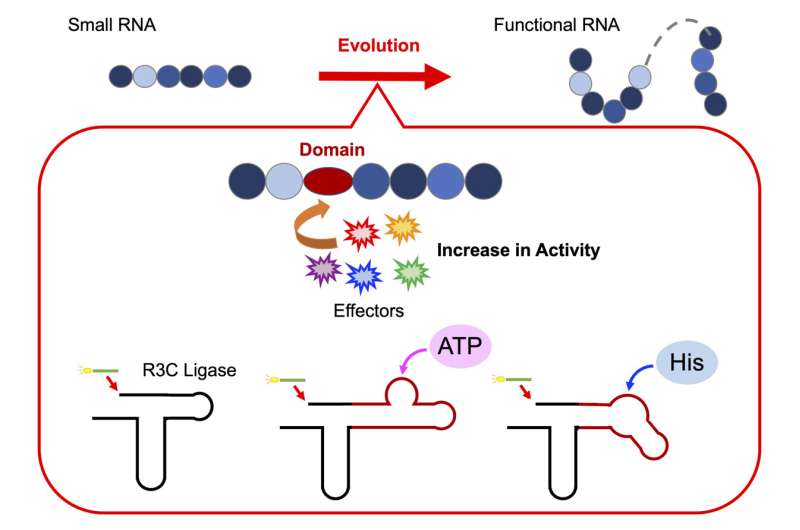
Para probar esta hipótesis, el profesor Koji Tamura, junto con su equipo de investigadores del Departamento de Ciencia y Tecnología Biológicas de la Universidad de Ciencias de Tokio, llevaron a cabo una serie de experimentos para decodificar el ensamblaje de ribozimas funcionales. Para ello, diseñaron una ribozima artificial, la ligasa R3C, para investigar cómo las unidades individuales de ARN se unen para formar una estructura funcional.
Su trabajo está publicado en la revista Life. .
Para profundizar más en su investigación, el profesor Tamura afirma:"La ligasa R3C es una ribozima que cataliza la formación de un enlace 3',5'-fosfodiéster entre dos moléculas de ARN. Modificamos la estructura agregando dominios específicos que pueden interactuar con varios efectores."
Dentro de los ribosomas, que son el sitio de síntesis de proteínas, las unidades de ARN se ensamblan para funcionar como centros de peptidil transferasa (PTC) de tal manera que forman un andamio para el reclutamiento de aminoácidos (componentes individuales de un péptido/proteína) unidos a los ARNt. .
Esta es una idea importante de la historia evolutiva de los sistemas de síntesis de proteínas, pero no es suficiente para rastrear el camino evolutivo basado en la hipótesis del mundo del ARN.
Para explorar si el alargamiento del ARN, logrado uniendo unidades individuales de ARN, está regulado alostéricamente, los investigadores alteraron la estructura de la ligasa R3C. Lo hicieron incorporando secuencias cortas de ARN que unen el trifosfato de adenosina (ATP), una molécula portadora de energía vital en las células, a la ribozima. El equipo observó que la actividad de la ligasa R3C dependía de la concentración de ATP, observándose una mayor actividad a concentraciones más altas de ATP.
Además, un aumento en la temperatura de fusión (Tm valor) indicó que la unión de ATP a la ligasa R3C estabilizó la estructura, lo que probablemente influyó en su actividad ligasa.
De manera similar, al fusionar una secuencia de ARN de unión a L-histidina con la ribozima, observaron un aumento en la actividad de la ligasa al aumentar las concentraciones de histidina (un aminoácido clave). En particular, el aumento de la actividad fue específico del aumento de concentraciones de ATP o histidina; no se observaron cambios en respuesta a otros nucleótidos trifosfatos o aminoácidos.
Estos hallazgos sugieren que el ATP y la histidina actúan como moléculas efectoras que desencadenan cambios conformacionales estructurales en la ribozima, que influyen aún más en la estabilidad y actividad de la enzima.
El ATP es el portador de energía central de la célula que sustenta numerosos procesos moleculares, mientras que la histidina es el aminoácido más común que se encuentra en el sitio activo de las enzimas y mantiene su química ácido-base. Dadas las importantes funciones del ATP y la histidina en las interacciones del ARN y las funciones moleculares, estos resultados proporcionan conocimientos novedosos sobre el papel del ARN en la evolución temprana, incluido el origen del código genético.
Además, las ribozimas diseñadas como la desarrollada en este estudio son muy prometedoras en una gran variedad de aplicaciones, incluida la administración dirigida de fármacos, terapias, nanobiosensores, ingeniería enzimática y síntesis de nuevas enzimas con usos en diversos procesos industriales.
En general, este estudio puede ofrecer información sobre cómo se produjo la transición del mundo del ARN al "mundo del ADN/proteína" moderno. A su vez, una comprensión fundamental del mundo del ARN puede mejorar su uso en aplicaciones de la vida real.
"Este estudio conducirá a la dilucidación del proceso de 'adquisición de función y cooperatividad basada en la alostericidad' en la evolución del ARN. Las interacciones ARN-ARN, las interacciones ARN-aminoácidos y la alostericidad aplicadas en esta investigación pueden guiar la fabricación de secuencias arbitrarias. Nanoestructuras de ARN, con diversas aplicaciones", concluye el profesor Tamura.
Más información: Yuna Akatsu et al, Desarrollo de ribozimas alostéricas para ATP y l-histidina basadas en la ribozima ligasa R3C, Life (2024). DOI:10.3390/vida14040520
Proporcionado por la Universidad de Ciencias de Tokio