Nada vive para siempre, pero en comparación con otras células del cuerpo, las células madre hematopoyéticas (HSC) tienen una vida notablemente larga. Las HSC son células productoras de sangre:dan lugar a células progenitoras que se dividen rápidamente, que a su vez generan cientos de miles de millones de células para satisfacer la demanda diaria de glóbulos rojos que suministran oxígeno, glóbulos blancos que combaten enfermedades y plaquetas que forman coágulos.
Las HSC generalmente permanecen inactivas dentro de la médula ósea, pero poseen la capacidad de activar y reponer las células sanguíneas continuamente, manteniendo un perfil relativamente joven durante toda la vida de un organismo. ¿Cuál es el secreto de las CMH de larga duración que protegen de los efectos del envejecimiento? Un equipo dirigido por investigadores de la Facultad de Medicina de Baylor ha revelado en Nature Cell Biology que la enzima ciclofilina A, que se produce en grandes cantidades en las HSC, es clave para que estas células conserven su potencial regenerativo y eviten los efectos del envejecimiento.
"Una fuerza impulsora del envejecimiento celular es la acumulación de proteínas que han llegado al final de su vida útil", dijo el autor correspondiente, el Dr. André Catic, profesor asistente y académico CPRIT en Investigación del Cáncer en el Centro Huffington sobre el Envejecimiento en Baylor. "Con la edad, las proteínas tienden a plegarse mal, agregarse y acumularse dentro de la célula, lo que genera estrés tóxico que puede alterar la función celular".
Las células que participan con frecuencia en la división celular, como las células progenitoras, pueden eliminar agregados de proteínas mediante dilución. Por otro lado, las HSC de larga vida, que no se dividen con frecuencia, enfrentan el problema de la acumulación de proteínas mal plegadas y el estrés tóxico posterior. Sin embargo, las HSC siguen siendo inmunes al envejecimiento. ¿Cómo lo hacen?
"Comprender los mecanismos moleculares que contribuyen al envejecimiento de las HSC no sólo contribuye al campo de la biología normal de las HSC, sino que también puede tener una relevancia clínica significativa para el tratamiento del cáncer", afirmó la coprimera autora del trabajo, la Dra. Lauren Maneix, que estuvo en el laboratorio Catic mientras trabajaba en este proyecto.
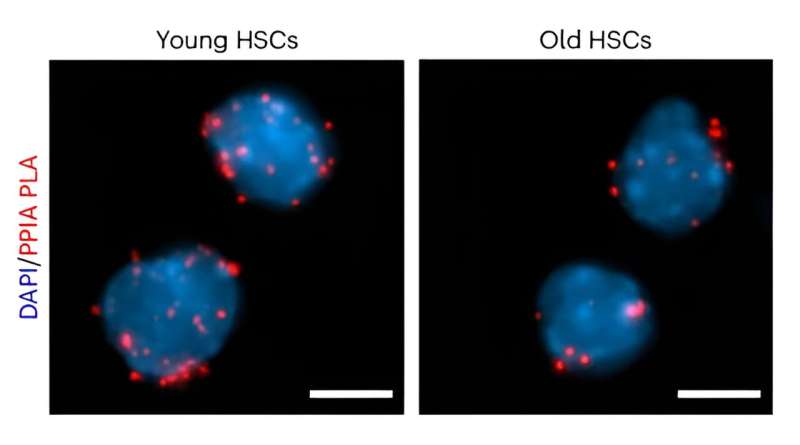
Estudios anteriores han demostrado que las células de mamíferos expresan varios cientos de chaperonas moleculares, proteínas que preservan o cambian la conformación tridimensional de las proteínas existentes. Las ciclofilinas, una de las chaperonas más abundantes, han sido implicadas en el proceso de envejecimiento. Sin embargo, no se ha estudiado previamente cómo afectan a las proteínas celulares.
Trabajando con ratones, los investigadores caracterizaron por primera vez el contenido de proteínas de las HSC y descubrieron que la ciclofilina A es una chaperona frecuente. Experimentos adicionales demostraron que la expresión de ciclofilina A disminuyó significativamente en las HSC envejecidas, y la eliminación genética de la ciclofilina A aceleró el envejecimiento natural en el compartimento de células madre. Por el contrario, la reintroducción de ciclofilina A en HSC envejecidas mejoró su función. En conjunto, estos hallazgos respaldan la ciclofilina A como un factor clave en la longevidad de las HSC.
A continuación, el equipo investigó las proteínas con las que interactúa la ciclofilina A, preservando su estabilidad. "Descubrimos que las proteínas enriquecidas en regiones intrínsecamente desordenadas son objetivos frecuentes de la chaperona", dijo Catic.
Las proteínas intrínsecamente desordenadas cambian naturalmente su conformación 3D para interactuar con diferentes proteínas, ácidos nucleicos u otras moléculas. En consecuencia, las proteínas ricas en regiones intrínsecamente desordenadas regulan muchos procesos celulares promoviendo actividades específicas entre moléculas.
"Debido a su naturaleza flexible, las proteínas intrínsecamente desordenadas son inherentemente propensas a la agregación. La ciclofilina A ayuda a estas proteínas a cumplir sus funciones y al mismo tiempo evita que se aglutinen", afirmó Catic.
Además, los hallazgos sugieren que la ciclofilina A interactúa con proteínas intrínsecamente desordenadas desde el momento de su síntesis. "A medida que se producen estas proteínas, la ciclofilina A se asegura de que mantengan las conformaciones apropiadas y se mantengan en niveles suficientes", dijo Catic. "El agotamiento genético de la ciclofilina A da como resultado que las células madre carezcan claramente de proteínas intrínsecamente desordenadas."
"Por primera vez, nuestro estudio demostró que la producción de proteínas desordenadas y el mantenimiento de la diversidad estructural de las proteínas en una célula desempeñan un papel en el envejecimiento de las HSC", afirmó Maneix.
Coautor principal Polina Iakova, Charles G. Lee, Shannon E. Moree, Xuan Lu, Gandhar K. Datar, Cedric T. Hill, Eric Spooner, Jordon C. K. King, David B. Sykes, Borja Saez, Bruno Di Stefano, Xi Chen, Daniela S. Krause, Ergun Sahin, Francis T. F. Tsai, Margaret A. Goodell, Bradford C. Berk y David T. Scadden también contribuyeron a este estudio.
Más información: Laure Maneix et al, La ciclofilina A apoya la traducción de proteínas intrínsecamente desordenadas y afecta el envejecimiento de las células madre hematopoyéticas, Nature Cell Biology (2024). DOI:10.1038/s41556-024-01387-x
Información de la revista: Biología celular natural
Proporcionado por Baylor College of Medicine