Mantener intacta la información genética almacenada en el ADN genómico durante el ciclo de división celular es crucial para casi todas las formas de vida. Un daño extenso en el ADN causa invariablemente varios reordenamientos genómicos adversos, que pueden provocar la muerte celular en el mejor de los casos y la aparición de enfermedades como el cáncer en el peor de los casos.
Afortunadamente, las células de los tres dominios de la vida comparten un peculiar mecanismo libre de errores para mantener la información genética, conocido como recombinación homóloga (HR).
El proceso de HR comienza cuando una célula encuentra daño en el ADN durante la síntesis de ADN o después, iniciando una cascada de eventos. Primero se reseca o corta el ADN dañado para crear extremos monocatenarios cerca del sitio dañado. Luego, estos extremos se emparejan con su región correspondiente en un cromosoma replicado disponible, también conocido como "cromátida hermana", que se utiliza esencialmente como plantilla para reparar el ADN dañado.
Como era de esperar, la vía de la FC involucra una gran cantidad de proteínas y maquinaria celular. Si bien la mayoría de estas proteínas y maquinaria celular están bien estudiadas, algunas de ellas siguen siendo algo enigmáticas. Tal es el caso de los reguladores de RAD51, una proteína encargada de reparar las roturas de la doble cadena del ADN.
Normalmente, RAD51 forma filamentos que ayudan a preservar las horquillas de replicación del ADN:disposiciones transitorias del ADN que a menudo ocurren durante la replicación del ADN, como en el colapso de las horquillas de replicación. La regulación adecuada de RAD51, así como la degradación de estos filamentos una vez cumplido su propósito, es esencial para la FC.
Sin embargo, los mecanismos precisos por los cuales la acumulación anormal de RAD51 conduce a la inestabilidad genética no se comprenden completamente y muchos reguladores positivos y negativos de RAD51 siguen sin estar claros.
Ahora, sin embargo, en un artículo reciente publicado en Nucleic Acid Research El 10 de abril de 2024, un equipo de investigación dirigido por el profesor Miki Shinoara del Departamento de Biociencia Avanzada de la Universidad de Kindai (Japón) investigó la estrecha relación entre RAD51 y FIGNL1, uno de sus reguladores clave. El coautor del estudio fue Kenichiro Matsuzaki, también del Departamento de Biociencia Avanzada de la Universidad de Kindai, y arroja una luz muy necesaria sobre las complejidades del proceso de recursos humanos.
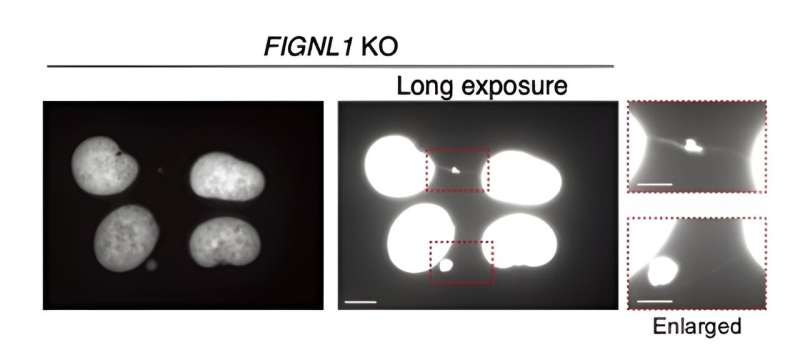
Primero, los investigadores diseñaron genéticamente células humanas que no expresaban FIGNL1 (es decir, células KO FIGNL1), utilizando el método CRISPR/Cas9 bien establecido. Luego, utilizando técnicas avanzadas de inmunotinción que implicaban anticuerpos cuidadosamente seleccionados y microscopía de fluorescencia, visualizaron el proceso de FC en detalle, buscando indicadores de anomalías.
Al combinar este enfoque con una gran cantidad de otros procedimientos experimentales, como la transferencia Western, el análisis del ciclo celular, los ensayos de proteínas y los análisis genómicos y transcriptómicos, lograron obtener una imagen completa de lo que sucede en una célula cuando falta FIGNL1. P>
Los resultados revelan que FIGNL1 es una enzima altamente especializada que desmantela RAD51 y que es necesaria para la separación adecuada de los cromosomas después de que se "desmontan" las horquillas de replicación.
Más específicamente, cuando los filamentos RAD51 no se desmantelan por completo, se producen eventos anormales durante la mitosis que producen intermediarios no resueltos. En última instancia, esto conduce a la formación de los llamados "puentes cromosómicos" entre las cromátidas hermanas. Estas estructuras ultrafinas son muy perjudiciales para el funcionamiento normal de la célula, provocando la propagación de información genética catastrófica.
Comprender los detalles más finos de la vía de recursos humanos, sus actores clave y sus numerosos subprocesos es extremadamente importante no sólo desde una perspectiva biológica, sino también desde un punto de vista médico.
"La muerte celular debida a la desregulación de la FC es un mecanismo importante por el cual los fármacos contra el cáncer presentan citotoxicidad específica de las células cancerosas", explica el profesor Shinohara. "Hasta ahora, el objetivo principal ha sido la deficiencia de activación de HR, pero los resultados de este estudio muestran que la activación persistente de RAD51 también presenta citotoxicidad y puede ser un objetivo molecular para medicamentos contra el cáncer".
Además, la maquinaria celular implicada en la vía de recursos humanos puede aprovecharse como una potente herramienta de bioingeniería.
"HR es un sistema bien conservado en la mayoría de las especies y también está estrechamente relacionado con las tecnologías de modificación genética, como la edición del genoma y las tecnologías de selección de genes", comenta el profesor Shinohara, "por lo tanto, se pueden dilucidar los mecanismos que controlan la actividad de la recombinasa, como el de RAD51, puede contribuir a aumentar la eficiencia de las técnicas de modificación genética."
Cabe señalar que la ingeniería genética es una vía muy eficaz para aumentar el rendimiento de los cultivos y personalizar los organismos microbianos para tareas como la biorremediación, que aborda diversos problemas del mundo moderno.
En general, los hallazgos de este estudio no sólo arrojan luz sobre un proceso biológico universal, sino que también allanan el camino hacia una mejor comprensión de los mecanismos celulares para importantes descubrimientos de fármacos y avances en el campo de la ingeniería genética.
Más información: Kenichiro Matsuzaki et al, Human AAA+ ATPase FIGNL1 suprime la formación de puentes ultrafinos mediada por RAD51, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae263
Información de la revista: Investigación sobre ácidos nucleicos , Investigación sobre ácidos nucleicos
Proporcionado por la Universidad de Kindai