Los sistemas CRISPR-Cas han revolucionado la biotecnología al ofrecer formas de editar genes como un par de tijeras programables. En la naturaleza, las bacterias utilizan estos sistemas para combatir virus mortales. Una reciente colaboración internacional liderada por la Universidad de Copenhague ha arrojado luz sobre los sistemas CRISPR-Cas más enigmáticos; El sistema tipo IV. Si bien estos sistemas atípicos no cortan genes, sus funciones únicas son prometedoras en nuestra lucha contra la resistencia a los antibióticos.
Los sistemas CRISPR-Cas son sistemas inmunológicos adaptativos bacterianos que atacan y cortan los ácidos nucleicos (ADN/ARN) de parásitos genéticos invasores como los bacteriófagos (fagos); virus que infectan (y eventualmente matan) células bacterianas. Constan de dos componentes principales; la matriz CRISPR, que almacena la memoria inmune de infecciones virales pasadas, y los genes cas (que codifican las proteínas Cas), responsables de coordinar las diferentes etapas de la respuesta inmune.
Actualmente existen seis tipos conocidos de sistemas CRISPR-Cas, clasificados según su composición proteica. Todos los tipos, excepto el tipo IV, incluyen nucleasas para la escisión de ADN/ARN.
Los sistemas CRISPR-Cas han ganado popularidad como herramientas de edición de genes, lo que permite cortes programables precisos en ubicaciones genómicas específicas, lo que en última instancia llevó a la concesión del Premio Nobel de Química 2020 por el desarrollo de esta tecnología.
"Los sistemas de tipo IV son primos extraños entre los sistemas CRISPR-Cas, ya que carecen del módulo de adquisición de memoria inmune y del componente de corte de ADN que han hecho tan famosos a los sistemas CRISPR-Cas. Estas características, y su estricta asociación con moléculas circulares móviles de ADN, llamados plásmidos, nos motivó a asumir la tarea de resolver su intrigante papel y sus funciones moleculares subyacentes", explica Fabienne Benz, posdoctorada de la Universidad de Copenhague y coautora primera de un estudio sobre este tema publicado en Cell Host &Microbe .
Dado que el sello distintivo de CRISPR-Cas es su capacidad para cortar ADN en sitios específicos, los sistemas de Tipo IV operan de una manera totalmente diferente. Carecen de las típicas "tijeras" de nucleasa, pero en su lugar albergan una helicasa DinG, una proteína misteriosa que desenrolla el ADN.
"El punto de inflexión en esta investigación se produjo cuando nos dimos cuenta de que los sistemas de tipo IV no cortan el ADN. En cambio, descubrimos que silencian la expresión genética en sus ubicaciones objetivo. Se trata de una funcionalidad única que podría tener importantes aplicaciones biotecnológicas", afirma Rafael Pinilla. -Redondo, profesora adjunta del Departamento de Biología y coordinadora principal de la investigación.
Los investigadores lograron otro gran avance cuando resolvieron cómo estos sistemas pueden funcionar sin los componentes necesarios para crear memoria inmune.
"Los sistemas de tipo IV pueden evitar la falta de un módulo de adquisición de memoria secuestrando módulos compatibles de otros sistemas CRISPR-Cas presentes en la bacteria huésped. Esto es fascinante porque estos otros sistemas sólo están relacionados lejanamente", explica Sarah Camara-Wilpert, co- primer autor de este estudio.
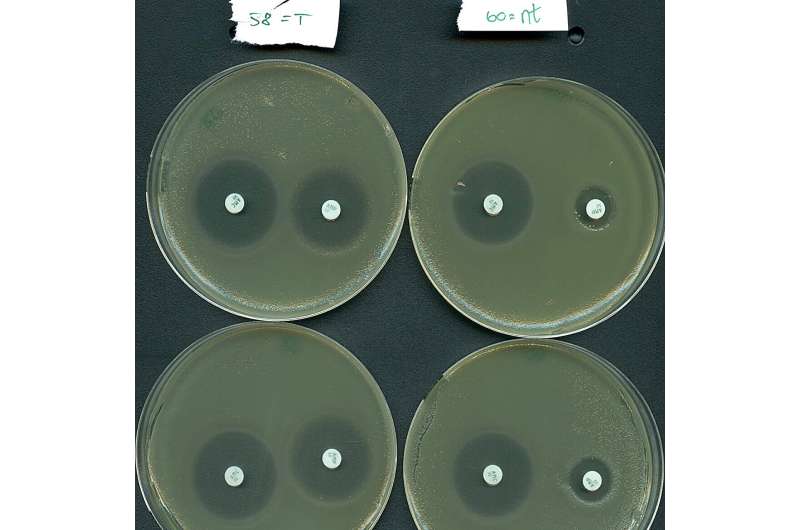
¿Pero a qué se debe todo este revuelo? Bueno, resulta que los sistemas de Tipo IV tienen una marcada tendencia a atacar naturalmente a los plásmidos, en lugar de a los virus bacterianos. Es importante destacar que los plásmidos objetivo con frecuencia albergan múltiples genes de resistencia a los antibióticos, como los que se encuentran en las superbacterias de los hospitales. Se estima que la resistencia a los antimicrobianos es directamente responsable de más de 1 millón de muertes al año debido al fracaso del tratamiento.
Inspirándose en su función natural de direccionamiento de plásmidos, los equipos de investigación reprogramaron eficazmente un sistema de tipo IV para silenciar selectivamente genes de resistencia transportados por una bacteria de alto riesgo procedente de pacientes hospitalizados.
"Nuestros resultados indican que los sistemas de Tipo IV tienen potencial como un nuevo medio para combatir la resistencia a los antibióticos, ya que pudimos volver a sensibilizar un patógeno importante al tratamiento con antibióticos", afirma el profesor Søren Sørensen, coautor del estudio. /P>
Este estudio fue un importante esfuerzo interdisciplinario que involucró a siete grupos de investigación internacionales de varios países. Si bien el proyecto comenzó como una colaboración entre solo dos grupos, gradualmente fue ganando impulso y atrayendo socios con experiencia diversa.
"Experimentamos un maravilloso efecto de bola de nieve, donde cada nuevo socio amplificó el impacto del trabajo al compartir sus habilidades únicas y brindar conocimientos cruciales para resolver los misterios que rodean los sistemas de tipo IV. Ha sido una hazaña colaborativa, exactamente como la ciencia debería ser", señala Pinilla-Redondo.
Más información: Fabienne Benz et al, los sistemas CRISPR-Cas tipo IV-A3 impulsan conflictos entre plásmidos mediante la adquisición de espaciadores en trans, célula huésped y microbio (2024). DOI:10.1016/j.chom.2024.04.016
Información de la revista: Hospedador celular y microbio
Proporcionado por la Universidad de Copenhague