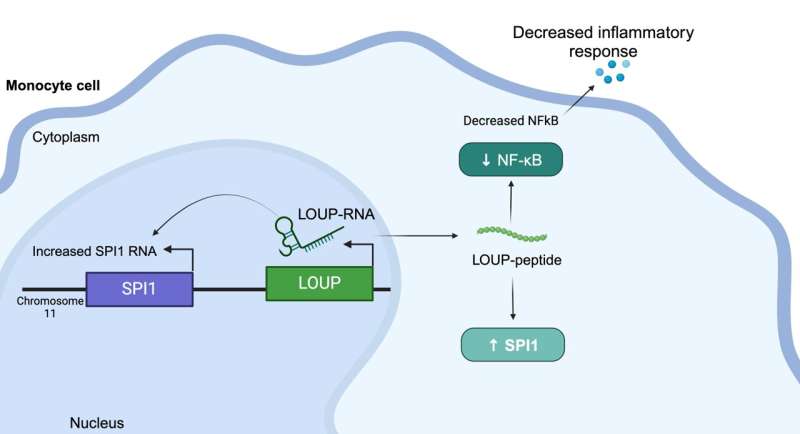
Investigadores de UC Santa Cruz han descubierto un péptido en el ARN humano que regula la inflamación y puede proporcionar una nueva vía para el tratamiento de enfermedades como la artritis y el lupus. El equipo utilizó un proceso de detección basado en la poderosa herramienta de edición genética CRISPR para arrojar luz sobre uno de los mayores misterios sobre nuestro ARN:la molécula responsable de llevar a cabo la información genética contenida en nuestro ADN.
Este péptido se origina en un largo ARN no codificante (lncRNA) llamado LOUP. Según los investigadores, el genoma humano codifica más de 20.000 lncRNA, lo que lo convierte en el grupo más grande de genes producidos a partir del genoma. Pero a pesar de esta abundancia, los científicos saben poco sobre por qué existen los lncRNA o qué hacen. Es por eso que a veces se hace referencia al lncRNA como la "materia oscura del genoma".
El estudio, publicado el 23 de mayo en las Proceedings of the National Academy of Sciences (PNAS), es uno de los pocos en la literatura existente que desvela los misterios del lncRNA. También presenta una nueva estrategia para realizar pruebas de detección de alto rendimiento para identificar rápidamente lncRNA funcionales en células inmunes. El enfoque de pantalla agrupada permite a los investigadores apuntar a miles de genes en un solo experimento, lo cual es una forma mucho más eficiente de estudiar porciones no caracterizadas del genoma que los experimentos tradicionales que se centran en un gen a la vez.
La investigación fue dirigida por la inmunóloga Susan Carpenter, profesora y presidenta Sinsheimer del Departamento de Biología Molecular, Celular y del Desarrollo de UC Santa Cruz. Estudia los mecanismos moleculares implicados en la protección contra las infecciones. Específicamente, se centra en los procesos que conducen a la inflamación para determinar el papel que desempeñan los lncRNA en estas vías.
"La inflamación es una característica central de casi todas las enfermedades", afirmó. "En este estudio, mi laboratorio se centró en tratar de determinar qué genes de ARNc están implicados en la regulación de la inflamación".
Esto significó estudiar los lncRNA en un tipo de glóbulo blanco conocido como monocito. Utilizaron una modificación de la tecnología CRISPR/Cas9, llamada inhibición CRISPR (CRISPRi), para reprimir la transcripción genética y descubrir cuál de los ARNlnc de un monocito desempeña un papel en su diferenciación en macrófago, otro tipo de glóbulo blanco que es fundamental para una respuesta inmune que funcione bien.
Además, los investigadores utilizaron CRISPRi para detectar el ARNlnc de macrófagos en busca de participación en la inflamación. Inesperadamente, localizaron una región que es multifuncional y puede funcionar como ARN, además de contener un péptido no descubierto que regula la inflamación.
Comprender que este péptido específico regula la inflamación les da a los fabricantes de medicamentos un objetivo para bloquear la interacción molecular detrás de esa respuesta con el fin de suprimirla, dijo Carpenter. "En un mundo ideal, se diseñaría una pequeña molécula para interrumpir esa interacción específica, en lugar de, por ejemplo, apuntar a una proteína que podría expresarse en todo el cuerpo", explicó. "Todavía estamos muy lejos de abordar estas vías con ese nivel de precisión, pero ese es definitivamente el objetivo. Hay mucho interés en la terapia de ARN en este momento".
Los coautores del estudio de UC Santa Cruz incluyen a Haley Halasz, Eric Malekos, Sergio Covarrubias, Samira Yitiz, Christy Montano, Lisa Sudek y Sol Katzman, junto con investigadores de UCSF y MIT.
Más información: Haley Halasz et al, las pantallas CRISPRi identifican el lncRNA, LOUP, como un locus multifuncional que regula la diferenciación de macrófagos y la señalización inflamatoria, Actas de la Academia Nacional de Ciencias (2024). DOI:10.1073/pnas.2322524121
Información de la revista: Actas de la Academia Nacional de Ciencias
Proporcionado por la Universidad de California - Santa Cruz