La transcripción de ARN es el proceso genómico en el que una célula produce un duplicado de la secuencia de ADN de un gen. En un estudio publicado en Nucleic Acids Research , el profesor Jun Zhang, Ph.D., del Departamento de Química de la Universidad de Alabama en Birmingham, y su equipo revelan cómo la proteína SRSF1 posee la novedosa función de unirse y desplegar complejos cuadruplex de ARN guanina.
Presente en secuencias de ADN y ARN, un G-quadruplex (GQ) es una estructura de cuatro bases de guanina unidas en una matriz plana. Estos conjuntos, conocidos como tétrada G, están conectados mediante pares de bases de Hoogsteen. Se ve comúnmente que tres o más capas de tétradas G son las que forman una estructura GQ.
En una célula que funciona normalmente, la mayoría de las GQ eventualmente se desenrollan, de modo que la información codificada por el ARN puede usarse para la expresión de proteínas. Los GQ se utilizan comúnmente para regular el nivel de expresión de proteínas. Sin embargo, debido a la extrema estabilidad de sus estructuras, los GQ son relativamente difíciles de desenrollar una vez formados en las células.
Por ejemplo, si el GQ no se desenrolla, el ribosoma no puede pasar y no se puede producir la proteína necesaria. Esta función reguladora es importante porque, si la proteína funciona para suprimir las células cancerosas, entonces la incapacidad de desenredar una secuencia GQ puede resultar en la replicación de células cancerosas y maliciosas.
"Esto es importante porque comprender cómo podemos abrir fácilmente estructuras GQ podría proporcionar otra vía hacia el futuro de las opciones de tratamiento para ciertas enfermedades", dijo Zhang. "Hasta ahora no existían otras herramientas externas que pudiéramos utilizar fácilmente para abrir estas estructuras en la célula".
Zhang y su equipo investigaron la familia de proteínas ricas en Ser/Arg, o SR.
Hay 12 miembros de la familia de proteínas SR. Esta familia de proteínas de unión a ARN es más conocida por el empalme de ARN. SRSF1 supervisa el empalme de más de 1500 transcripciones de ARN mensajero diferentes.
"El mal funcionamiento del empalme puede resultar en el desarrollo de diferentes enfermedades como el cáncer", dijo Zhang. "En realidad, alrededor del 60 % de las enfermedades pueden atribuirse al mal funcionamiento del empalme."
Cada miembro de la familia de proteínas SR consta de uno o dos motivos de reconocimiento de ARN N-terminal, o RRM, y una región proteica C-terminal fosforilable rica en dipéptidos Arg/Ser repetitivos, o RS.
El laboratorio de Zhang es el primero en solubilizar con éxito SRSF1 de longitud completa en su estado nativo. El equipo de Zhang utilizó esto para explorar el panorama de unión al ARN de SRSF1. Al hacerlo con éxito, el equipo de Zhang descubrió que SRSF1 RS prefiere la purina a la pirimidina.
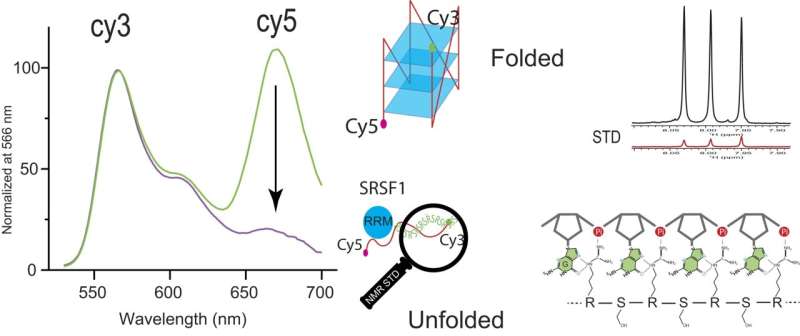
Al utilizar la transferencia de energía por resonancia de fluorescencia, o FRET, entre las sustancias químicas fluorescentes Cy3 y Cy5, Zhang y su equipo pudieron ver la disminución significativa de la señal de Cy5 al agregar SRSF1. Esta disminución significa una unión cooperativa de SRSF1 a ARPC2 GQ y un despliegue de ARPC2 GQ.
"Nuestros hallazgos son sólo un comienzo para comprender las funciones más amplias que desempeñan las proteínas SR en el empalme y la traducción del ARN", dijo Zhang. "Comprender estas propiedades es importante porque nos ayuda a comprender mejor cómo se regula la expresión de proteínas dentro de la célula".
Más información: Naiduwadura Ivon Upekala De Silva et al, Descubriendo una nueva función de SRSF1 en la unión y el despliegue de RNA G-quadruplexes, Investigación sobre ácidos nucleicos (2024). DOI:10.1093/nar/gkae213
Información de la revista: Investigación sobre ácidos nucleicos
Proporcionado por la Universidad de Alabama en Birmingham