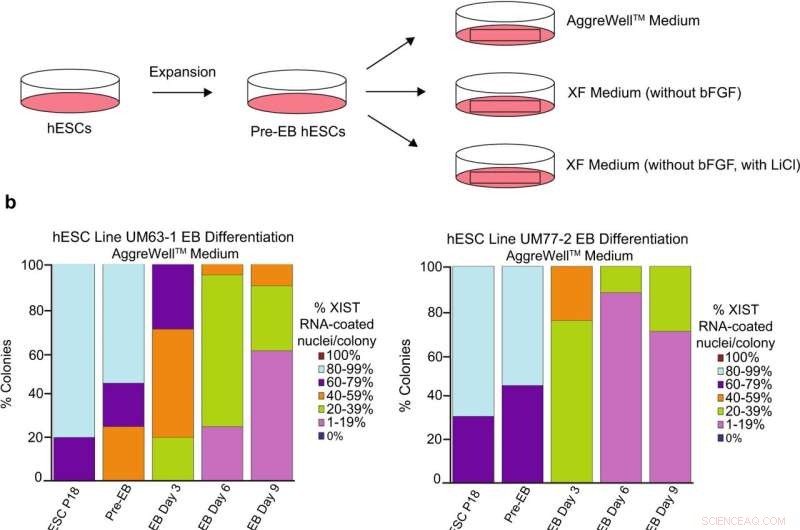
Análisis del recubrimiento de ARN XIST durante la diferenciación de hESC hembras. un esquema de la diferenciación de hESC en cuerpos embrioides (EB) con tres formulaciones de medios diferentes:un AggreWell TM disponible comercialmente medio; medio XF que carece de bFGF; y medio XF que carece de bFGF pero que contiene LiCl 0,98 mM. b Porcentaje de núcleos con recubrimiento de ARN XIST en EB generados a partir de las líneas hESC UM77-2 y UM63-1. EB generados y cultivados en medio XF con LiCl y AggreWell TM el medio perdió una proporción significativa del recubrimiento de ARN XIST por colonia en comparación con los EB generados y cultivados en medio XF (comparación general del modelo lineal; p < 0,001). Se contaron al menos 100 núcleos por colonia para la cuantificación de hESC RNA FISH. El número total de colonias cuantificadas en cada paso oscila entre 10 y 17 y están catalogadas en los datos de origen. Los datos de origen se proporcionan como un archivo de datos de origen. Crédito:Comunicaciones de la naturaleza (2022). DOI:10.1038/s41467-022-30259-x
En la mayoría de los mamíferos, las hembras tienen dos cromosomas X y los machos tienen un cromosoma X y uno Y en cada una de sus células. Para evitar una dosis doble de genes ligados al X en las hembras, uno de los X se silencia al principio del proceso de desarrollo. Este silenciamiento es crítico, pero cómo sucede ha sido relativamente misterioso. Dos nuevos estudios de la U-M revelan más sobre este proceso de silenciamiento y conocimientos que podrían mejorar la investigación con células madre.
Las células madre embrionarias humanas (hESC) son una gran promesa para la investigación del desarrollo temprano, así como para la medicina regenerativa para enfermedades que van desde la diabetes tipo 1 hasta la enfermedad de Parkinson. Sin embargo, los biólogos que trabajan con hESC femeninas en el laboratorio a menudo se encuentran con un fenómeno en el que el cromosoma X normalmente inactivado pierde esta supresión mientras crece en una placa de cultivo.
"Si no puede mantener las hESC exactamente como tales en cultivo, entonces no puede usarlas para ninguna aplicación posterior", dijo Sundeep Kalantry, Ph.D., profesor asociado de genética humana. Él, junto con Marissa Cloutier, Ph.D. aprendiz y su equipo se dispusieron a determinar por qué la inactivación X se erosiona bajo ciertas condiciones experimentales a lo largo del tiempo.
Su principal sospechoso era la sustancia utilizada para hacer crecer las células en cultivo, llamada medio. Las células se cultivan en medios que les proporcionan instrucciones químicas denominadas factores de crecimiento. Estos factores de crecimiento indican a las células madre que sigan dividiéndose. Un medio popular, llamado mTeSR1, parecía estar relacionado con la pérdida de un regulador clave de la inactivación de X, una cadena de ARN no codificante llamada XIST. Otro medio, llamado Xenofree, no condujo a una pérdida de inactivación X.
"Observamos las diferencias en la composición de estos dos medios e identificamos que el cloruro de litio estaba presente en mTeSR1 pero no en Xenofree", dijo Cloutier.
El cloruro de litio a veces se incluye en los medios para promover la proliferación de células madre; sin embargo, se sabe que interfiere con muchas vías de señalización celular al inhibir las proteínas GSK-3. (Los inhibidores de las proteínas GSK-3 se han utilizado para tratar varias enfermedades, y el litio, utilizado para tratar el trastorno bipolar, fue uno de los primeros inhibidores naturales de GSK-3 descubiertos).
Para confirmar que el cloruro de litio era el culpable, agregaron el compuesto al medio Xenofree y vieron una pérdida de inactivación X. Su artículo se publica en Nature Communications .
"En términos generales, en términos de nuestra comprensión de la inactivación de X, nuestro estudio proporciona un nuevo modelo posible para la regulación de este proceso", dice Cloutier. Kalantry agrega que su estudio sugiere que los investigadores deben ser un poco más cautelosos con el uso de inhibidores de GSK-3 como el litio. "Es posible que no solo interfieran con la inactivación de X, sino también con otros modos de regulación transcripcional epigenética en todo el genoma".
Papel de un antiguo gen ligado al cromosoma X en la inducción de la inactivación del cromosoma X
Un artículo separado, también publicado en Nature Communications por Kalantry y sus colegas, arroja información sobre la evolución de la inactivación de X en los mamíferos. La premisa del estudio fue que la inactivación del cromosoma X se desencadena por uno o más de un subconjunto de genes ligados al cromosoma X que, paradójicamente, escapan a la inactivación del cromosoma X una vez que ha comenzado. Estos genes se expresan a partir de ambos cromosomas X en las mujeres frente a un solo X en los hombres y, como resultado, se expresan más en las mujeres que en los hombres. El laboratorio de Kalantry, en estrecha colaboración con el laboratorio de Shigeki Iwase, también en la Universidad de Michigan, descubrió que debido a la mayor expresión en mujeres frente a hombres de uno de esos genes ligados al cromosoma X, Kdm5c, induce Xist y, por lo tanto, la inactivación de X selectivamente en mujeres. .
La eliminación de Kdm5c en ambos cromosomas X en una célula femenina desactivó casi por completo la inactivación de X. Por el contrario, cuando los investigadores introdujeron Kdm5c en células de ratón macho, iniciaron con éxito la inactivación X, que en circunstancias normales no ocurriría.
Kdm5c es un gen ancestral ligado al cromosoma X que comparten todas las especies de mamíferos. Los autores probaron y encontraron que Kdm5c de linajes de mamíferos marsupiales y monotremas (p. ej., el ornitorrinco que pone huevos) evolutivamente distantes, que se separaron de los mamíferos placentarios hace más de 150 millones de años, también podría inducir notablemente la inactivación de Xist y X en células de ratón macho. . Este hallazgo sugiere que Kdm5c ha conservado una función ancestral para inducir la inactivación de Xist y X en ratones y humanos.
"Si se expresan genes ligados al X a niveles más altos de lo normal en una célula femenina, esa célula a menudo sufrirá y morirá. En los hombres, si se reduce la expresión de genes ligados al X más allá de los niveles normales mediante la inactivación de ese único X, el las células también sufren y mueren", dijo Kalantry. "El nivel adecuado de genes del cromosoma X es muy, muy importante para la salud de la célula".
El equipo espera a continuación explicar el proceso aleatorio que determina qué X en una celda femenina es silenciada:la de la madre o la del padre. La determinación de este mecanismo básico, dice Kalantry, podría aplicarse en el futuro para reactivar genes ligados al X a voluntad con posibles fines terapéuticos.