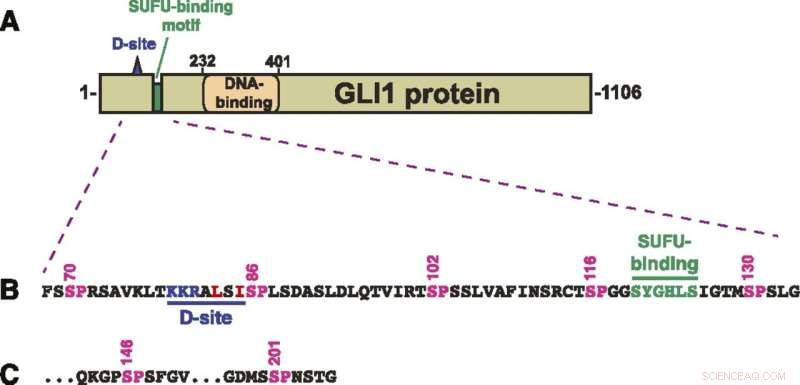
Estructura de la proteína GLI1. (A) Esquema de la estructura primaria de la proteína GLI1 humana, que muestra el sitio de acoplamiento MAPK (sitio D), el motivo de unión SUFU y el dominio de unión al ADN con dedos de zinc. El dominio de activación transcripcional constituye una gran fracción de la mitad C-terminal de la proteína. (B) Secuencia de aminoácidos de los residuos 68–134, que muestra el sitio D, el motivo de unión a SUFU y un grupo de cinco sitios canónicos de fosforilación de MAPK (SP). Los números anteriores muestran la posición de los residuos de serina en los sitios SP. (C) Los dos últimos de los siete sitios de fosforilación de SP MAPK contenidos en residuos de 68-232 GLI1. Después de S201, el siguiente sitio SP o TP se produce en S441. Crédito:A. Jane Bardwell et al, Life Science Alliance (2022). DOI:10.26508/lsa.202101353
Mejores tratamientos para algunas de las formas más mortales de cáncer podrían estar más cerca debido a un descubrimiento liderado por la Universidad de California en Irvine sobre cómo se activa cierta proteína en las células tumorales. El hallazgo, encabezado por investigadores de la Facultad de Ciencias Biológicas, podría eventualmente conducir a posibles terapias para el melanoma y el adenocarcinoma pancreático especialmente peligrosos, así como para el tipo más común de cáncer cerebral infantil y cáncer de piel en adultos. Un artículo que describe el proyecto aparece en Life Science Alliance .
El descubrimiento se refiere a la proteína GLI1, que es importante en el desarrollo celular pero que también se ha encontrado activada en varios tipos de cáncer. GLI1 normalmente se activa mediante la vía de señalización Hedgehog, conocida como HH. Sin embargo, los científicos han sabido durante aproximadamente una década que la diafonía (interacción) entre HH y la vía de la proteína quinasa activada por mitógeno tiene un papel en los cánceres.
"En algunos casos, las proteínas en una vía pueden activar las proteínas en otra", dijo la autora principal A. Jane Bardwell, científica del proyecto en el Departamento de Biología Celular y del Desarrollo de la UCI. "Es un sistema complejo. Queríamos entender el mecanismo molecular que hace que GLI1 sea activado por proteínas en la vía MAPK".
GLI1 normalmente se une fuertemente con una proteína llamada SUFU. Esa proteína suprime GLI1, evitando que penetre en los núcleos celulares y active los genes. Los científicos examinaron siete sitios en la proteína GLI1 que podrían fosforilarse o transferirse un grupo fosfato.
"Identificamos tres que pueden fosforilarse y están involucrados en el debilitamiento de la unión entre GLI1 y SUFU", dijo Lee Bardwell, profesor de biología celular y del desarrollo, cuyo laboratorio realizó el proyecto. "Este proceso activa GLI1, lo que le permite ingresar al núcleo de las células, donde puede causar un crecimiento descontrolado que resulta en cáncer".
Señaló que la fosforilación de los tres sitios provoca un nivel significativamente mayor de escape de GLI1 de SUFU que si solo uno o incluso dos de ellos recibieran grupos fosfato.
El descubrimiento es un paso significativo hacia tratamientos contra el cáncer más efectivos y personalizados. "Si podemos entender exactamente lo que está pasando en un determinado cáncer o tumor en particular, podría ser posible desarrollar un fármaco específico para un tumor específico o un paciente individual", dijo Bardwell. "Nos permitiría tratar estas enfermedades sin la toxicidad de la quimioterapia básica". Además, muchos tumores del mismo cáncer tienen diferentes mutaciones entre los individuos. Eventualmente, puede ser factible examinar los tumores para desarrollar el mejor enfoque para cada uno.
La investigación se realizó en colaboración con el Departamento de Microbiología y Genética Molecular de la Facultad de Medicina de la UCI y el Departamento de Dermatología de la Facultad de Medicina de la Universidad de Stanford.