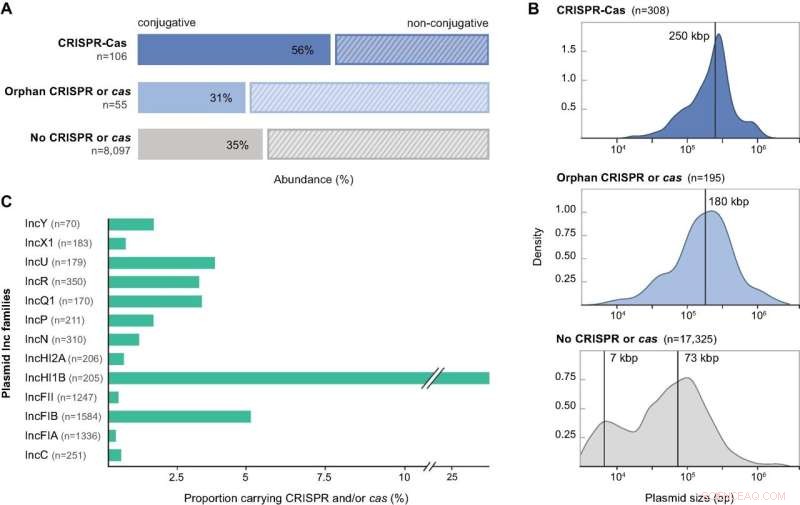
Características de los plásmidos que codifican componentes CRISPR-Cas. (A) Predicciones de movilidad para la colección de plásmidos proteobacterianos no redundantes analizados en este estudio, presentados según su contenido CRISPR-Cas:loci CRISPR-Cas completo, CRISPR o cas huérfanos y sin CRISPR o cas. (B) Distribuciones de tamaño para la colección de genomas de plásmidos que llevan loci CRISPR-Cas completos, matrices huérfanas, operones cas solos y sin genes CRISPR o cas. Las líneas verticales indican el tamaño mediano del plásmido para las distribuciones unimodales y las medias estimadas de un modelo de mezcla gaussiana de 2 componentes para la distribución bimodal. Las densidades se calculan con parámetros predeterminados en base R. (C) Distribución de grupos de incompatibilidad de plásmidos dentro de la fracción tipificable Inc del conjunto de datos de plásmidos completo y abundancia relativa del subconjunto que codifica loci CRISPR-Cas. Los plásmidos individuales pueden pertenecer a más de un grupo Inc. Solo se muestran los grupos Inc que contienen más de 10 plásmidos. Crédito:Investigación de ácidos nucleicos DOI:10.1093/nar/gkab859
CRISPR-Cas se ha convertido en una especie de superestrella durante la última década como una herramienta de edición de genes con un potencial revolucionario, especialmente en las ciencias de la salud. Conocido originalmente como una defensa inmunológica en las bacterias, el CRISPR-Cas de origen natural ha demostrado ser más diverso y versátil en su naturaleza de lo que alguna vez creyeron los investigadores científicos. Ahora, un grupo de investigadores del Departamento de Biología de la Universidad de Copenhague ha investigado la prevalencia de los sistemas CRISPR-Cas en plásmidos.
Los investigadores examinaron más de 30 000 genomas de plásmidos completos y encontraron CRISPR-Cas en aproximadamente el tres por ciento de ellos, una proporción alta incluso en comparación con las bacterias. También encontraron varios representantes de hasta cinco de los seis tipos conocidos de CRISPR-Cas en los genomas de plásmidos estudiados. Los resultados demuestran que los sistemas CRISPR-Cas están muy extendidos y son diversos en plásmidos y, curiosamente, que la gran mayoría de ellos se dirigen a otros plásmidos.
"En parte, esto es emocionante porque respalda una comprensión más reciente de que los plásmidos tienen un mayor grado de autonomía de sus células anfitrionas, generalmente bacterias. Pero también, porque a largo plazo, puede abrir caminos para combatir la virulencia y la resistencia. en las bacterias, cuyos plásmidos ayudan a propagarse", explica Rafael Pinilla-Redondo, uno de los principales investigadores del estudio y trabaja en el Departamento de Biología de la Universidad de Copenhague.
CRISPR actúa como un GPS genómico, donde se puede usar una memoria almacenada de fragmentos de ADN extraños para localizar un objetivo para las proteínas Cas, las "tijeras genéticas". En la mayoría de los hallazgos del estudio, fue el ADN de otros plásmidos lo que se descubrió en la memoria inmunológica de los sistemas CRISPR-Cas, es decir, colocado en el punto de mira.
Parte de un cambio de paradigma
Según los investigadores, esto sugiere una lucha por los recursos entre los plásmidos, donde los plásmidos sirven a sus propios intereses al trabajar activamente para evitar que otros plásmidos accedan a la bacteria huésped en la que residen. En esta batalla, usan CRISPR como arma.
Los investigadores tuvieron la oportunidad de examinar simultáneamente la bacteria huésped del conjunto de datos de más de 30 000 plásmidos para las mismas secuencias CRISPR-Cas. La idea era estudiar si las secuencias encontradas en los plásmidos reflejaban los contenidos de CRISPR en las células huésped, pero en general no era así.
"Nuestros hallazgos sugieren que los plásmidos tienen un alto grado de autonomía de las bacterias en las que viven. Si bien los plásmidos dependen de su anfitrión, también son entidades genéticamente independientes que sirven a sus propios intereses. Su diferente contenido de CRISPR-Cas es un gran ejemplo de esta autonomía", dice Rafael Pinilla-Redondo.
Los nuevos resultados de la investigación contribuirán a lo que los investigadores consideran un cambio de paradigma en microbiología. En microbiología, el flujo de genes o la transferencia de genes se refiere a cuando el material genético se mueve entre las células, mediado por elementos genéticos móviles. Mientras que se permite que algunos elementos genéticos móviles entren en beneficio de una célula, otros se detienen porque son perjudiciales. El entendimiento común ha sido durante mucho tiempo que las bacterias controlan el flujo de genes.
El cambio de paradigma apunta a una comprensión en la que las bacterias en realidad juegan un papel mucho menos importante que influye en el flujo de genes.
"Lo que antes se suponía que eran bacterias que luchaban para protegerse de los parásitos genéticos, como virus y plásmidos, es mucho más complejo. Tal vez, debería entenderse mejor como los parásitos que luchan entre sí, por ejemplo, sobre cuáles se les debe permitir viven detrás de una oreja de vaca", explica Rafael Pinilla-Redondo.
La posibilidad de nuevas armas contra la resistencia a los antibióticos
El nuevo conocimiento sobre cómo los plásmidos usan CRISPR puede afectar la forma en que combatimos las bacterias peligrosas en el futuro. Los plásmidos son clave para la propagación de genes dañinos entre bacterias a través de lo que se conoce como transferencia horizontal de genes.
La proliferación de material genético es crucial para la capacidad de las bacterias para adaptarse a nuevos entornos y desafíos. A partir de una bacteria resistente a los antibióticos, un plásmido puede copiarse a sí mismo y transferir esa propiedad a las bacterias circundantes como parte de su propio ADN.
Como tal, las batallas entre plásmidos también pueden ayudar a los investigadores a aprender más sobre cómo combatirlos.
"Al comprender cómo los plásmidos compiten entre sí, podemos aprender a reducir su velocidad y, por lo tanto, retrasar la propagación de la resistencia a los antibióticos y las propiedades virulentas y dañinas entre las bacterias", dice Søren Johannes Sørensen, profesor de microbiología y coautor de el artículo de investigación.
"A largo plazo, es posible que podamos hacer nuestras las estrategias de los plásmidos y usarlos como herramientas. Sin tomar prestado de la naturaleza, estaríamos bastante limitados. Pero si podemos aprender sobre las fortalezas y debilidades de los plásmidos de ellos mismos, surgirán oportunidades", dice.
¿Qué significa CRISPR-Cas?
Los fragmentos de ADN (CRISPR) y las tijeras de proteína Cas (p. ej., Cas9) pueden localizar secuencias de ADN específicas y cortarlas.
Se predice que CRISPR-Cas desempeñará un papel revolucionario como herramienta de edición de genes, sobre todo en las ciencias de la salud, para el tratamiento de trastornos genéticos, entre otras cosas.
Los sistemas CRISPR se consideraron originalmente como un sistema inmunitario para las bacterias, en particular contra los virus. Sin embargo, muchos investigadores ahora ven a CRISPR-Cas como una herramienta de "armas a sueldo" que puede ser implementada para una multitud de propósitos, por muchos actores diferentes, incluidas bacterias, plásmidos y humanos.
¿Qué es un plásmido?
Un plásmido es una pequeña molécula de ADN en forma de anillo, el denominado elemento genético móvil, que se encuentra en las bacterias y otros tipos de microorganismos.
Recuerda a los virus, ya que ambos son parásitos dentro de las células. Los plásmidos pueden reproducirse independientemente de la célula huésped y, a menudo, brindan beneficios a la célula huésped.
Entre otras cosas, pueden otorgar o transferir propiedades genéticas a una bacteria, como hacerla resistente a los antibióticos o patógena, en un proceso conocido como transferencia horizontal de genes.
Los plásmidos han sido durante mucho tiempo una herramienta importante en biología molecular para, entre otras cosas, la clonación de genes y la introducción de material genético en células bacterianas.
¿Qué es la transferencia horizontal de genes?
La transferencia horizontal de genes es cuando un organismo transfiere genes a otro organismo que no es su propia descendencia.
En gran medida, la capacidad de las bacterias para adaptarse a nuevos entornos y desafíos depende del suministro de nuevos genes de esta manera.
El fenómeno es responsable de la inminente crisis de resistencia a los antibióticos, ya que las bacterias desarrollan rápidamente resistencia a los antibióticos mediante la adquisición de genes resistentes. Muy a menudo está mediada por plásmidos, lo que hace que la proliferación de plásmidos sea un problema de salud pública mundial.
Acerca del estudio:los investigadores crearon un escáner CRISPR
Para estudiar la prevalencia de CRISPR-Cas en plásmidos, los investigadores utilizaron la mayor colección de genomas de plásmidos completamente secuenciados, un conjunto de datos compilado por investigadores de todo el mundo.
Para administrar las grandes cantidades de datos, los investigadores del Departamento de Biología desarrollaron un software para buscar partes conocidas de CRISPR. Desde entonces, el programa, llamado CRISPRCasTyper, se ha puesto a disposición de otros investigadores de forma gratuita. Los humanos no son los primeros en reutilizar CRISPR