Impresión artística de una unidad organizativa de ADN desmontada, un dominio de asociación topológica (TAD). En el análisis de datos, estos dominios aparecen como triángulos que pueden reestructurarse en diferentes tejidos. Crédito:Alessa Ringel/MPIMG
Las capas de control de genes permiten que el ADN agregue nueva información de manera flexible. Los genes y sus interruptores genéticos se organizan en unidades funcionales para activar o desactivar los genes según sea necesario. La interrupción de estas unidades puede provocar enfermedades, pero un nuevo estudio deja en claro que son más sólidas y flexibles de lo que se pensaba anteriormente. Un equipo internacional de investigadores descubrió que un gen aún puede funcionar incluso cuando se insertan nuevos segmentos de ADN en la misma unidad organizativa genómica.
Se introducen dos metros de ADN en el diminuto núcleo de cada célula humana. Para proporcionar a la célula la información correcta en el momento adecuado, la molécula de ADN se empaqueta y agrupa de manera eficiente en unidades funcionales. Los genes generalmente se reúnen con sus secuencias de control para construir espacios de trabajo separados físicamente. Pero, ¿qué sucede cuando estas unidades se alteran durante la evolución o en el genoma de un paciente individual?
"Algunos de los reordenamientos genómicos que vemos en la clínica causan enfermedades, mientras que otros no", dice Stefan Mundlos de Charité—Universitätsmedizin Berlin y director del grupo de investigación Desarrollo y Enfermedades del Instituto Max Planck de Genética Molecular (MPIMG). "Todavía no entendemos completamente por qué este es el caso".
De hecho, muchas partes del genoma contienen conflictos regulatorios. Un nuevo estudio publicado en la revista Cell da las primeras pistas de cómo se resuelven. El equipo de investigadores de Mundlos estudió un ejemplo en el que un nuevo gen se ha integrado con éxito en el genoma sin alterar los mecanismos de control preexistentes de los genes vecinos. El equipo esperaba que esto también pudiera usarse para sacar conclusiones sobre circunstancias similares en las células de los pacientes.
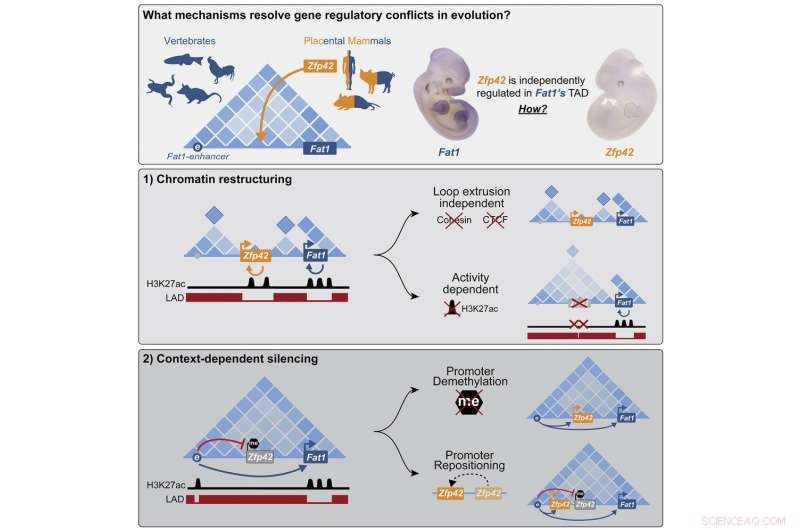
Los investigadores exploraron una mutación que ocurrió en el antepasado de todos los mamíferos placentarios, un grupo que incluye a los humanos, pero no a los marsupiales como la zarigüeya. La mutación insertó el nuevo gen Zfp42 justo en el espacio de trabajo del importante gen de desarrollo Fat1, un gen que está involucrado en el crecimiento y la migración de las células.
"Descubrimos que las células hacen frente al huésped no deseado con dos mecanismos separados, según la situación en la que se necesitan los genes", dice Michael Robson, quien dirigió el proyecto. "En ciertos tejidos, el nuevo gen se silencia epigenéticamente y se apaga por completo. Sin embargo, durante el desarrollo temprano del embrión, ambos genes están activos y la célula reconstruye esta parte del genoma en nuevas unidades funcionales que permiten el control individual".
Un recién llegado al taller
Robson, su Ph.D. la estudiante Alessa Ringel y sus colegas investigaron el espacio de trabajo organizacional de Fat1. Como muchos otros genes, recibe instrucciones de activarse en momentos y lugares específicos mediante otras secuencias de ADN denominadas potenciadores. Para permitir que los potenciadores y los genes se comuniquen, el ADN luego se pliega y dobla para unirlos en un espacio de trabajo protegido. Estas unidades funcionales de trabajo del ADN se denominan dominios topológicamente asociados (TAD).
En pollos o zarigüeyas, solo el gen Fat1 se encuentra en el mismo TAD que sus potenciadores. Cuando el investigador empleó la técnica "Hi-C" para ver qué partes del ADN se tocan entre sí con mayor frecuencia, el gen y su potenciador se comportaron como se esperaba. En estos animales, el ADN parecía enrollarse en una sola bola, lo que permitía que ambas secuencias genéticas se entremezclaran, activando así Fat1.
“Pero en mamíferos placentarios como ratones o humanos es un poco más complicado”, explica Ringel, quien es el primer autor de la publicación. Justo entre el gen Fat1 y su potenciador, se encuentra este nuevo gen llamado Zfp42. El mismo potenciador debería controlar ambos genes, pero no es así. "Ambos genes parecen llevarse bien:tienen un comportamiento completamente independiente y se activan en diferentes tejidos en diferentes momentos del desarrollo".
Gráficamente abstracto. Crédito:Celular (2022). DOI:10.1016/j.cell.2022.09.006
Vete a dormir o reconstruye tu espacio de trabajo
Para llegar al fondo de la cuestión de cómo los genes se las arreglan para evitarse unos a otros, los investigadores compararon células de diferentes tejidos de ratón:la extremidad embrionaria en desarrollo y las células madre embrionarias.
A partir de estos estudios, los investigadores aprendieron que en las extremidades embrionarias el potenciador contacta ambos genes, pero Zfp42 permanece inactivo. Resulta que el recién llegado todavía está en el mismo espacio de trabajo, pero duerme tranquilamente en un rincón. El gen había sido silenciado por la metilación del ADN, una modificación química que bloquea los genes en un estado desactivado. Pero para que el gen Zfp42 duerma, debe estar exactamente en el lugar correcto. Tan pronto como los investigadores lo cortaron y pegaron experimentalmente un poco a cada lado, el potenciador de Fat1 lo activó.
Los científicos se sorprendieron al descubrir que en las células madre embrionarias de ratón, el ADN alrededor de los dos genes está organizado de manera completamente diferente. Zfp42 y Fat1 ahora construyen sus propios espacios de trabajo separados físicamente con sus respectivos potenciadores.
El TAD original se divide en gotas de ADN más pequeñas para separar los dos genes. Esto fue evidente no solo a partir de los experimentos Hi-C que mapearon los puntos de contacto entre los segmentos de ADN, sino también a partir de imágenes microscópicas de alta resolución y modelos informáticos que mostraron que cada gen estableció su propio pequeño espacio de trabajo.
Un sistema robusto y flexible de control genético
Estos dos nuevos mecanismos revelan cómo un solo "espacio de trabajo" de ADN puede modificarse fácilmente para albergar actividades genéticas completamente diferentes. "Es fascinante estudiar cómo se complementan las diferentes capas de control genético", dice Ringel. "Nos ha sorprendido la flexibilidad de nuestros genomas para adaptarse y controlar genes en diferentes situaciones. Por ejemplo, nuestros resultados muestran que los TAD pueden tener estructuras de ADN dinámicas en lugar de estáticas".
El TAD del gen Fat1 se ha mantenido estable durante cientos de millones de años de evolución desde peces y ranas hasta marsupiales, añade Robson, líder del proyecto. "Los espacios de trabajo de TAD al principio parecen frágiles, ya que muchas cosas pueden salir mal si se alteran", dice. "Pero los nuevos genes tienen que ir a alguna parte y mostramos cómo la evolución puede modificar efectivamente los dominios reguladores para agregar nuevos genes y funciones de manera segura".
"Curiosamente, este entorno evolutivo refleja lo que vemos a menudo en pacientes con alteraciones genómicas extremas como la cromotripsis", dice Mundlos. "Estos pacientes pueden tener cromosomas destrozados pero aún así tener síntomas relativamente leves. Esto podría explicarse a través de estos mecanismos reguladores adicionales que compensan los efectos nocivos mediante el uso de las herramientas que el genoma tiene a su disposición". Explorando los límites moleculares en el ADN