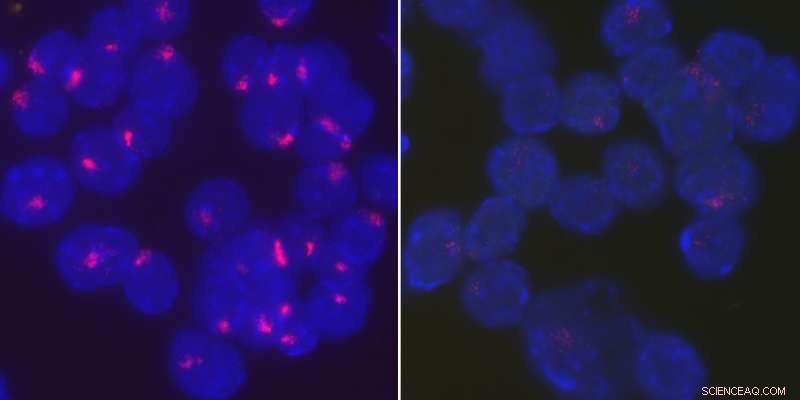
Los investigadores encontraron que la proteína YY1 devuelve el ARN de Xist al cromosoma X inactivo para mantener la inactivación del cromosoma X en las células B estimuladas. Activado, las células B de tipo salvaje de ratones hembra localizan estrechamente el ARN de Xist en sus cromosomas X inactivos (izquierda), mientras que el ARN de Xist se dispersa por todo el núcleo cuando se elimina YY1 (derecha). Crédito:Universidad de Pensilvania
Las enfermedades autoinmunes tienden a afectar más a las mujeres que a los hombres y tener múltiples cromosomas X podría ser la razón principal. Mientras que un proceso llamado inactivación del cromosoma X sirve para equilibrar la dosis de genes entre hombres y mujeres, algunos genes en el cromosoma "X inactivo" en las células inmunes a veces pueden escapar de este proceso, dar a las mujeres una dosis extra de expresión génica relacionada con la inmunidad.
En un nuevo estudio, un equipo de la Universidad de Pensilvania describe cómo la inactivación del cromosoma X se regula en las células B del sistema inmunológico a medida que se desarrollan en la médula ósea y cuando se encuentran con antígenos. Su trabajo dilucida una dinámica, Mecanismo de dos pasos en las mujeres mediante el cual las células B que carecen de los marcadores de inactivación del cromosoma X recuperan estas modificaciones durante la activación de las células B, en un proceso que involucra el factor de transcripción YY1.
"Lo que es notable es que las células B son las que producen anticuerpos y autoanticuerpos, por lo que son realmente cruciales tanto en la respuesta inmunitaria protectora como en la autoinmunidad, "dijo Montserrat C. Anguera, profesor asistente en el Departamento de Ciencias Biomédicas de la Facultad de Medicina Veterinaria de Penn y autor principal del estudio. "Una gran pregunta que queda es:¿Por qué estas células inmunitarias se preparan para que este cromosoma se regule de manera diferente y también, Si estos procesos salen mal, ¿Cómo conduce eso a la autoinmunidad y la pérdida de la auto-tolerancia? "
El estudio, publicado en PLOS Genetics , fue dirigido por Camille M. Syrett, estudiante de doctorado en el laboratorio de Anguera. Coautores, representando tanto a Penn Vet como a la Facultad de Medicina Perelman de Penn, fueron Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro y Michael Atchison.
En un estudio del año pasado en la revista procedimientos de la Academia Nacional de Ciencias , Anguera y sus colegas encontraron que ingenuo, linfocitos femeninos no estimulados, las células B y T del sistema inmunológico, no logró inactivar completamente un cromosoma X. La investigación mostró que esto se debía a que Xist, una larga transcripción de ARN no codificante bien conocida por iniciar y mantener el proceso de inactivación del cromosoma X, no se pudo localizar en el cromosoma X inactivo. Cuando se activaron las células inmunes, o preparado para responder a la infección, Xist RNA reapareció en el lugar adecuado.
"Vimos que las células B inactivadas no tienen esta nube de ARN, pero vuelve al estímulo, ", dijo Syrett." Estábamos realmente interesados en determinar qué está devolviendo el ARN Xist ".
Usando una molécula de seguimiento fluorescente, El equipo comenzó rastreando la ubicación de Xist en el desarrollo de células B en ratones hembra. Descubrieron que los precursores de las células B, tales como células madre hematopoyéticas y progenitores linfoides comunes, tenía patrones claros de ARN Xist en el cromosoma X inactivo. Pero, a medida que estos precursores de células B siguieron un camino de desarrollo para convertirse en células B, El ARN Xist primero pareció desaparecer, luego reaparecer, pero solo como pinchazos difusos a través del núcleo en lugar de estar localizados en el X inactivo.
Además, etiquetas de moléculas pequeñas llamadas modificaciones de heterocromatina, que se sabe que mantienen la represión génica durante la inactivación del crrosomoma X, desapareció durante el desarrollo de las células B.
"Pudimos ver estos cambios realmente inusuales en el nivel de cromatina en el desarrollo de las células B femeninas, "Dijo Anguera.
Para averiguar cómo el Xist volvió a la X inactiva tras la activación de las células B, como habían mostrado en el artículo PNAS del año pasado, los investigadores rastrearon el ARN de Xist en células B en cultivo. Descubrieron que la reaparición tuvo lugar en dos fases distintas:entre cuatro y 16 horas después de que se estimularon las células, empezaron a aparecer las motas de Xist RNA. Y entre 16 y 30 horas después de la estimulación, Xist RNA concentrado exclusivamente en el cromosoma X inactivo. Las modificaciones de heterocromatina también parecieron aumentar y localizarse en el X inactivo en esta segunda fase.
El estudio anterior del equipo había señalado que la proteína YY1 desempeñaba un papel en el retorno de Xist en las células B activadas. así que empezaron a mirarlo más de cerca en este trabajo. Atchison, líder en estudios de YY1 en el desarrollo de células B, pudo prestar su experiencia para investigar el papel de la proteína en la inactivación del cromosoma X.
Cuando los investigadores examinaron las células B de ratones que carecían de YY1, vieron niveles muy reducidos de marcas de heterocromatina, así como una menor localización del ARN de Xist en el X inactivo.
El equipo también observó evidencia de que YY1 estaba influyendo en la expresión de genes del cromosoma X. Cuando eliminaron YY1 de células masculinas y femeninas y compararon genes que se expresaron diferencialmente en el cromosoma X, encontraron 68 que eran específicos para mujeres, uno que era específico para hombres y 11 que fueron compartidos.
De los 68 genes específicos de las mujeres, muchos estaban relacionados con la inmunidad, y se sabe que al menos dos se sobreexpresan en células B femeninas humanas en comparación con las células B masculinas.
Otro conjunto de experimentos identificó el área de YY1 con actividad de unión al ADN como el dominio clave de esta proteína involucrada en llevar el ARN de Xist al X inactivo.
"Parece estar actuando como una atadura, unir el ARN Xist con el ADN del cromosoma X inactivo, "Dijo Anguera.
Ella y sus colegas explorarán más a fondo el papel de YY1, utilizando muestras clínicas y modelos de ratón, observar la proteína en enfermedades como el lupus para profundizar su comprensión de cómo la autoinmunidad podría resultar del "escape" de genes inmunes de la inactivación del cromosoma X.
"Si desea desarrollar una terapia para las enfermedades autoinmunes, la idea es, ¿Cómo hacemos que Xist llegue al cromosoma X inactivo y lo mantenemos allí para mantener la compensación de dosis en estas células B ", dijo Anguera." Ciertamente, YY1 parece un objetivo realmente prometedor ".