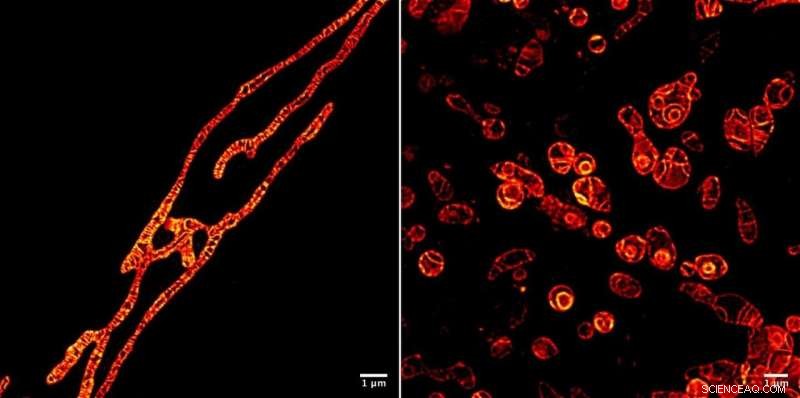
Membranas internas de mitocondrias vivas bajo un microscopio STED obtenidas con la molécula marcadora fluorescente amarilla MitoPB creada por investigadores del Instituto de Bio-Moléculas Transformativas (ITbM) de la Universidad de Nagoya. Las membranas externas de las mitocondrias son invisibles. La molécula marcadora puede resistir el rayo STED durante un tiempo relativamente largo, que permite la obtención de imágenes de lapso de tiempo del sujeto vivo. La preparación de la muestra es mucho más fácil para un microscopio óptico que para un microscopio electrónico de transmisión (TEM), requiriendo aproximadamente una hora en lugar de un día. Las células no se pueden obtener imágenes vivas usando TEM. Las mitocondrias se han tratado con un reactivo que suprime la replicación del ADN, inducir disfunción, para ver sus procesos de supervivencia (izquierda) y muerte (derecha). Ser capaz de ver los procesos de disfunción que ocurren dentro de las mitocondrias conducirá a una mejor manera de diagnosticar la enfermedad mitocondrial humana, y tal vez incluso a una cura. Crédito:© ITbM, Universidad de Nagoya
La microscopía óptica es la única forma en que podemos mirar dentro de una célula viva, o tejidos vivos, en tres dimensiones. Un microscopio electrónico solo ofrece una vista bidimensional, y la muestra orgánica se quemaría rápidamente debido al calor extremo del haz de electrones, y por lo tanto no se puede observar con vida. Es más, marcando las biomoléculas de la estructura que nos interesa con una molécula fluorescente especialmente diseñada, podemos distinguirlo del entorno:esto es microscopía de fluorescencia.
Hasta mediados de la década de 1990, la microscopía de fluorescencia se vio obstaculizada por la física básica:debido al límite de difracción, cualquier característica de la muestra que esté más cerca de unos 250 nanómetros se verá borrosa. Los virus y las proteínas individuales son mucho más pequeños que esto, por lo que no podrían estudiarse de esta manera. Pero alrededor de 1994, en una maravillosa lección que nos enseña que debemos tener cuidado al aplicar los principios físicos fundamentales, Stefan Hell descubrió la microscopía de agotamiento de emisiones estimuladas (STED), que ahora es uno de varios enfoques de microscopía óptica que logran "superresolución, "resolución más allá del límite de difracción. Recibió el Premio Nobel de Química en 2014" por el desarrollo de microscopía de fluorescencia superesuelta, "junto con Eric Betzig y William Moerner.
Para ver por qué el límite de difracción es un problema, imagina que la estructura de interés es muy pequeña, decir, 50 nanómetros de ancho, como un virus, y se ha marcado con una biomolécula fluorescente. Ahora imagina iluminarlo con un punto láser, decir, 200 nanómetros de diámetro. Las moléculas marcadoras iluminadas emiten luz de forma espontánea, en momentos aleatorios, por fluorescencia, con la probabilidad disminuyendo rápidamente con el tiempo. Los fotones de muchas moléculas fluorescentes se enfocan en un detector que usa lentes, creando un solo píxel sin rasgos distintivos. No es completamente brillante porque solo una pequeña proporción de la muestra en el círculo iluminado contiene moléculas fluorescentes. Si tuviera que mover el láser 200 nanómetros en cualquier dirección, A donde, en este ejemplo, no hay moléculas fluorescentes presentes, la señal ciertamente se apagará. Entonces, este píxel bastante tenue nos dice que algo está presente dentro de esta área de muestra de 200 nanómetros de diámetro. El límite de difracción nos impide formar píxeles de áreas más pequeñas, si usamos el enfoque básico.
La idea física de la microscopía STED es muy simple. Con el punto láser iluminando la región alrededor de la pequeña estructura fluorescente nuevamente, suponga que de alguna manera detiene el envío de luz al detector desde un área lo más grande posible dentro del lugar, dejando un lugar mucho más pequeño, decir, 60 nanómetros de diámetro. Ahora, si mueve el láser 60 nanómetros en cualquier dirección y la señal se apaga, el píxel de la imagen representa la presencia de una estructura de hasta 60 nanómetros de ancho. Se ha superado el límite de difracción. Por supuesto, uno de esos píxeles no tiene rasgos distintivos, pero se puede crear una imagen nítida de las mitocondrias escaneando y registrando muchos píxeles de brillo variable. (Consulte la Figura 1. Se utilizó "microscopía STED controlada por tiempo" para capturar la mayoría de las imágenes de este documento).
El descubrimiento ganador del Premio Nobel de Stefan Hell consta de dos ideas. Primero, pensó en la idea de detener el envío de luz al detector desde un área lo más grande posible dentro de un punto iluminado cuyo tamaño coincida con el límite de difracción. Segundo, descubrió cómo lograrlo realmente.
Dos láseres iluminan el mismo lugar. El primer láser excita los electrones de la molécula marcadora y estos se desintegran espontáneamente a su estado fundamental, cada uno emite un fotón visible de una longitud de onda específica. (Esto es fluorescencia). El proceso es aleatorio, con la probabilidad de emisión disminuyendo con el tiempo con bastante rapidez, lo que significa que la mayoría de los fotones se emiten en los primeros nanosegundos de la muestra que se ilumina. Un segundo láser el "haz STED, "formada con un agujero en el medio para no afectar las moléculas marcadoras allí, está sintonizado para estimular la emisión de un fotón por la molécula marcadora excitada en el anillo exterior. Pero, ¿cómo se distinguen estos fotones de los fotones emitidos desde el medio?
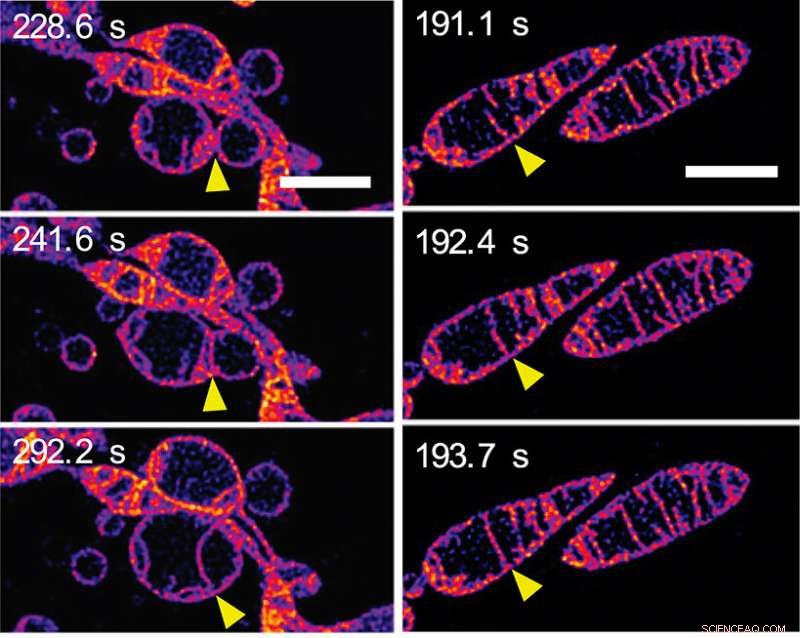
En respuesta a la privación de nutrientes, las mitocondrias se fusionan y aumentan el número de crestas. (a) Cuadros de una secuencia de lapso de tiempo que muestran dos mitocondrias separadas fusionándose para formar una sola mitocondria. Las membranas externas de las mitocondrias son invisibles:vemos que las membranas internas se fusionan. (b) Cuadros de una secuencia de lapso de tiempo que muestran dos crestas dentro de una sola mitocondria fusionándose. (Consulte el Video 2 en el Material complementario en la página web PNAS del documento). Las barras de escala representan 2 mm. Crédito:© ITbM, Universidad de Nagoya
El proceso de emisión del anillo exterior también es aleatorio, pero ocurre mucho más rápido, la probabilidad disminuye rápidamente, lo que significa que la mayoría de estos fotones se emiten en un nanosegundo más o menos. A medida que los dos haces superpuestos escanean a través de la muestra, para cuando el centro del anillo esté fluorescente, las moléculas circundantes ya han sido forzadas a su estado fundamental mediante la emisión de un fotón; han sido "apagadas". La técnica de microscopía STED se basa en una sincronización inteligente de esta manera. En principio, el tamaño del punto central brillante se puede hacer tan pequeño como desee, por lo que cualquier resolución es posible. Sin embargo, el "rayo STED" en forma de rosquilla estaría entregando energía en forma de luz láser visible concentrada a un área más grande de la célula viva, arriesgándose a matarlo.
Sin embargo, el proceso no es ideal, y la imagen resultante pierde algo de nitidez porque algunas moléculas marcadoras en el anillo exterior no están apagadas correctamente; el proceso es probabilístico, después de todo, y cuando emiten fluorescencia, contaminan la señal del centro. Sin embargo, debido a la diferente sincronización de la emisión espontánea y estimulada, los primeros fotones que llegan al detector son de regiones iluminadas por la mayor intensidad del haz STED, y lo más probable es que los últimos fotones en llegar provengan de moléculas marcadoras ubicadas en el punto central. Entonces, al esperar un poco de tiempo (alrededor de un nanosegundo) antes de grabar la imagen, la mayoría de los fotones del anillo exterior se pueden filtrar. Esto se denomina "microscopía STED controlada por tiempo". Se logra una mayor nitidez de la imagen a través de un proceso llamado deconvolución.
La invención de la microscopía de superresolución supuso un salto adelante en las ciencias de la vida. Se pudieron observar organismos vivos con una resolución sin precedentes. Sin embargo, No se pudieron hacer secuencias de imágenes en intervalos de tiempo durante un período de tiempo decente porque las moléculas marcadoras se degradarían bajo el intenso haz STED y dejarían de emitir fluorescencia. Este es el problema del fotoblanqueo. Las moléculas marcadoras dañadas también pueden volverse tóxicas para la célula.
El problema del fotoblanqueo resuelto
Shigehiro Yamaguchi y Masayasu Taki, del Instituto de Biomoléculas Transformadoras (ITbM) de la Universidad de Nagoya, dirigió un equipo de investigación que ha desarrollado una molécula marcadora, llamado "MitoPB Yellow, "que es absorbido por la membrana interna de las mitocondrias, incluidas las crestas, las estructuras en forma de pliegue, y tiene una vida útil prolongada bajo una viga STED. La idea de la molécula marcadora dirigida a las mitocondrias vino del coautor Chenguang Wang, de la ITbM. También es posible obtener imágenes STED multicolor con un solo láser STED; y los investigadores esperan que los marcadores fluorescentes similares al MitoPB Yellow también encuentren una amplia gama de aplicaciones en otras técnicas de superresolución (como las desarrolladas por Eric Betzig y William Moerner).
Para demostrar la utilidad práctica de MitoPB Yellow para la obtención de imágenes de células vivas, el grupo colocó las mitocondrias en condiciones que se sabe que causan ciertos cambios estructurales, pero hasta ahora estos solo se han observado mediante microscopía electrónica de transmisión, que no se puede utilizar en células vivas. Las mitocondrias se trataron con un reactivo que suprime la replicación del ADN, inducir disfunción, para observar sus procesos de supervivencia y muerte.
Luego, utilizando microscopía STED controlada por tiempo, el equipo de investigación tomó imágenes fijas con una resolución de 60 nanómetros (aproximadamente una milésima parte del ancho de un cabello humano), así como secuencias de imágenes de lapso de tiempo que muestran a las mitocondrias respondiendo a una privación de nutrientes cambiando de forma para sobrevivir. Las secuencias de imágenes largas, de hasta 600 imágenes, son las primeras hechas de mitocondrias con una resolución espacial relativamente alta de 90 nanómetros. (Ver video 1, que muestra una secuencia de lapso de tiempo grabada durante casi 7 minutos).
En unos pocos minutos, la estructura mitocondrial interna cambió drásticamente de varias maneras. Inicialmente, Se observó alargamiento y aumento del número de crestas. Una secuencia de imágenes (ver Figura 2a) muestra las membranas internas de las mitocondrias vecinas fusionándose, en otras palabras, dos mitocondrias fusionándose para formar una. Otra secuencia de imágenes (ver Figura 2b) muestra dos crestas dentro de una sola mitocondria aparentemente fusionándose. Se cree que el alargamiento y la creación de más crestas aumentan la eficiencia de la producción de energía (síntesis de ATP) al tiempo que protegen a la mitocondria de la "degradación autofagosómica", una muerte programada cuyo propósito es eliminar los componentes innecesarios o disfuncionales de la célula y permitir la degradación y el reciclaje ordenados. de componentes celulares.
Después del período inicial de alargamiento, las membranas internas de algunas mitocondrias se dividieron en glóbulos que se hincharon y perdieron las crestas (ver Película S2); algunos glóbulos se rompieron (Película S4). Algunas formaron esferas concéntricas (Figura 1 y Video 1). La intensidad de la fluorescencia se mantuvo igual. Aquí es digno de mención que las crestas y las membranas permanecen tan nítidas como antes, lo que indica que la causa de la muerte de la mitocondria no es la toxicidad debido a la degradación de la molécula marcadora debajo del haz. El láser STED extremadamente potente podría haber dañado las mitocondrias, aunque se desconoce exactamente por qué se rompen.
En estas imágenes, después de ver las respuestas iniciales de supervivencia, estamos viendo la muerte de las mitocondrias bajo el intenso rayo STED. Una dirección futura de la investigación será reducir la intensidad del rayo láser STED mediante la creación de una molécula marcadora fluorescente que brilla cuando se ilumina con luz de una longitud de onda más larga y, por lo tanto, de menor energía. Las mitocondrias podrían vivir más tiempo.
Sin embargo, incluso con MitoPB Yellow, se puede estudiar el proceso de la muerte, que no se comprende bien. Nadie sabe si los cambios morfológicos (estructurales) observados durante el proceso de muerte están relacionados con la apoptosis (normal, muerte controlada) o necrosis (muerte por lesión o mal funcionamiento). Se sabe que la apoptosis se desencadena por una molécula de señalización llamada citocromo C:si se puede encontrar un reactivo que suprima el citocromo C, luego, las mitocondrias, y las células humanas, podrían vivir más tiempo.
Ser capaz de ver los procesos que ocurren dentro de las mitocondrias debería conducir a una mejor manera de diagnosticar la enfermedad mitocondrial humana, y tal vez incluso a una cura.