Ilustración. Plata. Crédito:@ tsarcyanide / MIPT
Investigadores del Instituto de Física y Tecnología de Moscú se han asociado con colegas en Rusia y Arabia Saudita y propusieron un método eficiente para obtener datos fundamentales necesarios para comprender los procesos químicos y físicos que involucran sustancias en estado gaseoso. El protocolo numérico propuesto predice el efecto térmico de la formación en fase gaseosa de compuestos de plata y su entropía absoluta. Esto incluye los primeros datos de este tipo para más de 90 compuestos. Publicado en la revista Química Inorgánica , los hallazgos son importantes para aplicaciones prácticas de sustancias que contienen plata, incluso en agua y desinfección de heridas, fotografía y siembra de nubes.
El equipo derivó los valores precisos de la entalpía de formación y la entropía de numerosos compuestos de plata. La entalpía (del griego "thalpein, "que significa" calentar ") de un sistema describe su estado en términos de la energía de las partículas constituyentes, presión y volumen. Según la ley de Hess, Al multiplicar los coeficientes estequiométricos y la diferencia entre las entalpías de formación de los reactivos y las de los productos, se obtiene la cantidad de calor generado o consumido en una reacción química. La entropía es una medida de cuán desordenado está un sistema. La segunda ley de la termodinámica establece que un sistema puede adoptar espontáneamente un estado menos organizado, por lo que la entropía aumenta con el tiempo.
Conocer los valores de entalpía y entropía es crucial para predecir si alguna vez se producirá una reacción en determinadas condiciones. Estas características también indican cómo el rendimiento y la selectividad de la reacción (la relación entre los productos) varían con la temperatura y la presión, permitiendo la optimización. Los hallazgos permiten a los investigadores hacer predicciones sobre los procesos químicos que ocurren en la fase gaseosa. Los datos también ayudarán a administrar los procesos involucrados en la deposición de película delgada y muestra pura de la fase gaseosa.
Básicamente, hay dos formas de determinar los cambios de entalpía y entropía:a través de experimentos complejos y costosos, o usando los datos de los libros de referencia y haciendo algo de aritmética basada en la ley de Hess.
"La elección parece obvia, más aún considerando que no se puede medir experimentalmente el calor de algunas reacciones, "dijo Yury Minenkov, investigador senior del Laboratorio de Métodos de Supercomputación en Física de la Materia Condensada. "Por ejemplo, La combustión incompleta del grafito siempre produce tanto monóxido de carbono como dióxido de carbono. Entonces, incluso midiendo el efecto térmico de la reacción, no pudimos determinar la entalpía de formación de monóxido de carbono.
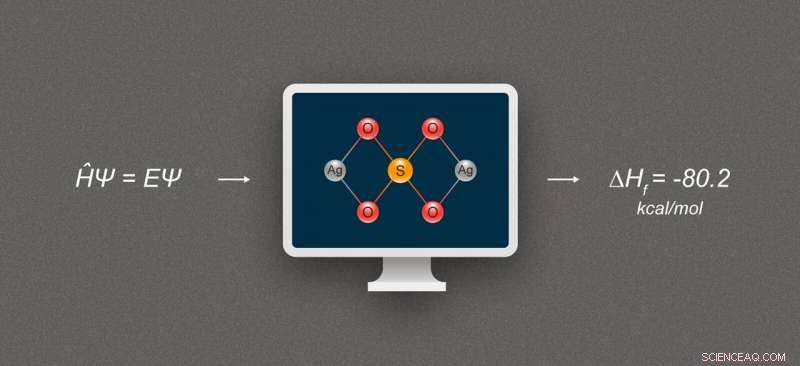
Figura 1. Diagrama simplificado que ilustra el cálculo de la entalpía de formación para compuestos de plata. El compuesto representado es sulfato de plata, Ag₂SO₄. Crédito:@ tsarcyanide / MIPT
"Pero el enfoque computacional enfrenta algunos problemas, "Minenkov prosiguió." Primero, las entalpías de formación y las entropías no se conocen para todos los compuestos. Segundo, incluso si los datos están disponibles, nadie puede garantizar su exactitud. Los valores varían ampliamente entre los libros de referencia. A veces, los errores de medición pueden ser bastante grandes ".
Afortunadamente, La química cuántica ayuda a obtener la entropía y, hasta cierto punto, los datos de entalpía. Cada molécula constituyente de una sustancia gaseosa puede verse como un sistema de núcleos cargados positivamente y electrones cargados negativamente. Luego, los investigadores pueden aplicar métodos de cálculo de estructuras electrónicas para resolver la ecuación molecular de Schrödinger. Esto revela la energía electrónica total de la molécula, su función de onda, y la configuración espacial de los núcleos, es decir, su estructura geométrica tridimensional. Luego, los físicos pueden calcular la entropía y la entalpía de un gas ideal compuesto por tales moléculas. Los valores de entropía obtenidos de esta manera se introducen luego en libros de referencia y se utilizan en cálculos termodinámicos.
El problema con la entalpía es que, no siendo un valor fundamental en este punto, depende significativamente del método elegido para el cálculo de la ecuación de Schrödinger.
Las reacciones de atomización se emplean generalmente para calcular la entalpía de formación. En tales reacciones, el compuesto de interés se descompone en átomos individuales. Por ejemplo, sulfuro de plata — Ag 2 S:produce un átomo de azufre y dos de plata. Dado que las entalpías de formación de sustancias atómicas son bien conocidas y se informan en libros de referencia, es posible calcular la entalpía de formación de la sustancia inicial; en este caso, sulfuro de plata:al encontrar el cambio de entalpía en la reacción mediante métodos de química cuántica.
Sin embargo, cuando las moléculas compuestas por muchos átomos se atomizan, esto afecta la estructura electrónica hasta tal punto que la entalpía, también, ha cambiado significativamente. Los métodos de química teórica actualmente disponibles no pueden explicar estos efectos con suficiente precisión.
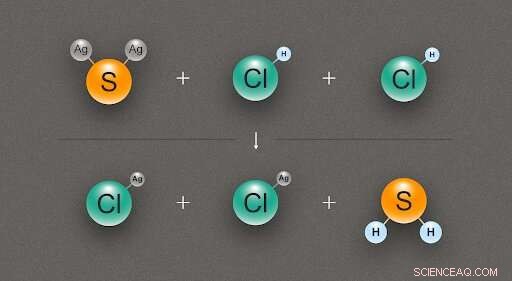
Figura 2. Un diagrama que ilustra la reacción química entre una molécula de sulfuro de plata (Ag₂S) y dos moléculas de ácido clorhídrico (HCl), produciendo dos moléculas de cloruro de plata (AgCl) y una de sulfuro de hidrógeno (H₂S). Crédito:@ tsarcyanide / MIPT
El equipo de investigadores del MIPT, el Instituto Frumkin de Química Física y Electroquímica de la Academia de Ciencias de Rusia, Universidad Estatal de Química y Tecnología de Ivanovo, y la Universidad de Ciencia y Tecnología King Abdullah de Arabia Saudita ha publicado una serie de artículos que proponen una forma de calcular las características termodinámicas de los compuestos orgánicos e inorgánicos con mayor precisión.
En el caso del sulfuro de plata, los investigadores encontraron su entalpía de formación a partir de la reacción con ácido clorhídrico, que produce cloruro de plata y sulfuro de hidrógeno (fig. 2). Dado que el número de enlaces en la fila superior es el mismo que en la fila inferior, el cambio de energía se puede calcular con el mínimo error.
El calor de formación del cloruro de plata, sulfuro de hidrógeno, y el ácido clorhídrico son conocidos con gran precisión, y el modelado por computadora revela el efecto térmico de la reacción. A partir de estos datos, es posible derivar el calor de formación del sulfuro de plata usando la ley de Hess.
"El enfoque clásico de clúster acoplado, conocido como CCSD (T), es el estándar de oro para resolver la ecuación electrónica de Schrödinger en la química cuántica moderna, "Minenkov explicó." Lo reemplazamos con la versión local llamada DLPNO-CCSD (T), que se desarrolló no hace mucho en el Instituto Max Planck. Esto redujo la potencia de cálculo requerida en un orden de magnitud. Bajo el CCSD (T) convencional, el tiempo de cálculo varía con el tamaño N de la molécula como N 7 , por lo que no es una opción para moléculas grandes. La versión local consume mucho menos tiempo y recursos ".
El equipo comenzó verificando qué tan bien los resultados de sus cálculos químicos cuánticos coincidían con los datos experimentales termodinámicos y estructurales. Los libros de referencia informaron los valores de 10 compuestos de plata, y eran un buen partido. Habiéndose asegurado así de que su modelo es adecuado, los investigadores calcularon las características termodinámicas de 90 compuestos de plata que faltan en los libros. Los datos son útiles tanto para los científicos que trabajan en el campo de la química de la plata como para probar y calibrar nuevos métodos de cálculo de estructuras electrónicas.